Hvad omfatter denne NBV?
Udredning og behandling af Graves’ sygdom (diffus toksisk struma), Multinodøs toksisk struma samt solitært toksisk adenom hos voksne ikke gravide
Hvad omfatter denne NBV ikke?
Udredning og behandling af thyroiditis (se NBV thyroiditis), behandling af thyrotoksikose hos børn og gravide
Diagnosekoder
E05.0 Graves´ thyrotoksikose
E05.1 Solitært toksisk adenom
E05.2 Toksisk multinodøs struma
Definition
I praksis bruges begreberne hyperthyroidisme, hyperthyreose og thyrotoksikose ofte som synonymer, men thyrotoksikose defineres som en øget forekomst af thyroideahormon i blodet, mens hyperthyroidisme/hyperthyreose defineres som en øget produktion af thyroideahormon fra gl. thyroidea.
Forekomst
I Danmark diagnosticeres årligt 80/100.000 svarende til ca. 5.000 nye tilfælde af hyperthyroidisme. Kvinde- mand ratio 4-5:1. Diffus toksisk struma er den hyppigste subtype < 60 år, mens multinodulær er den hyppigste hos patienter > 60 år 1;2. Livstidsrisiko i Danmark er 10,5 % for kvinder og 2,4 % for mænd 2.
Diagnose
Figur 1. Diagnostisk algoritme baseret på målinger af TSH, T3 og T4
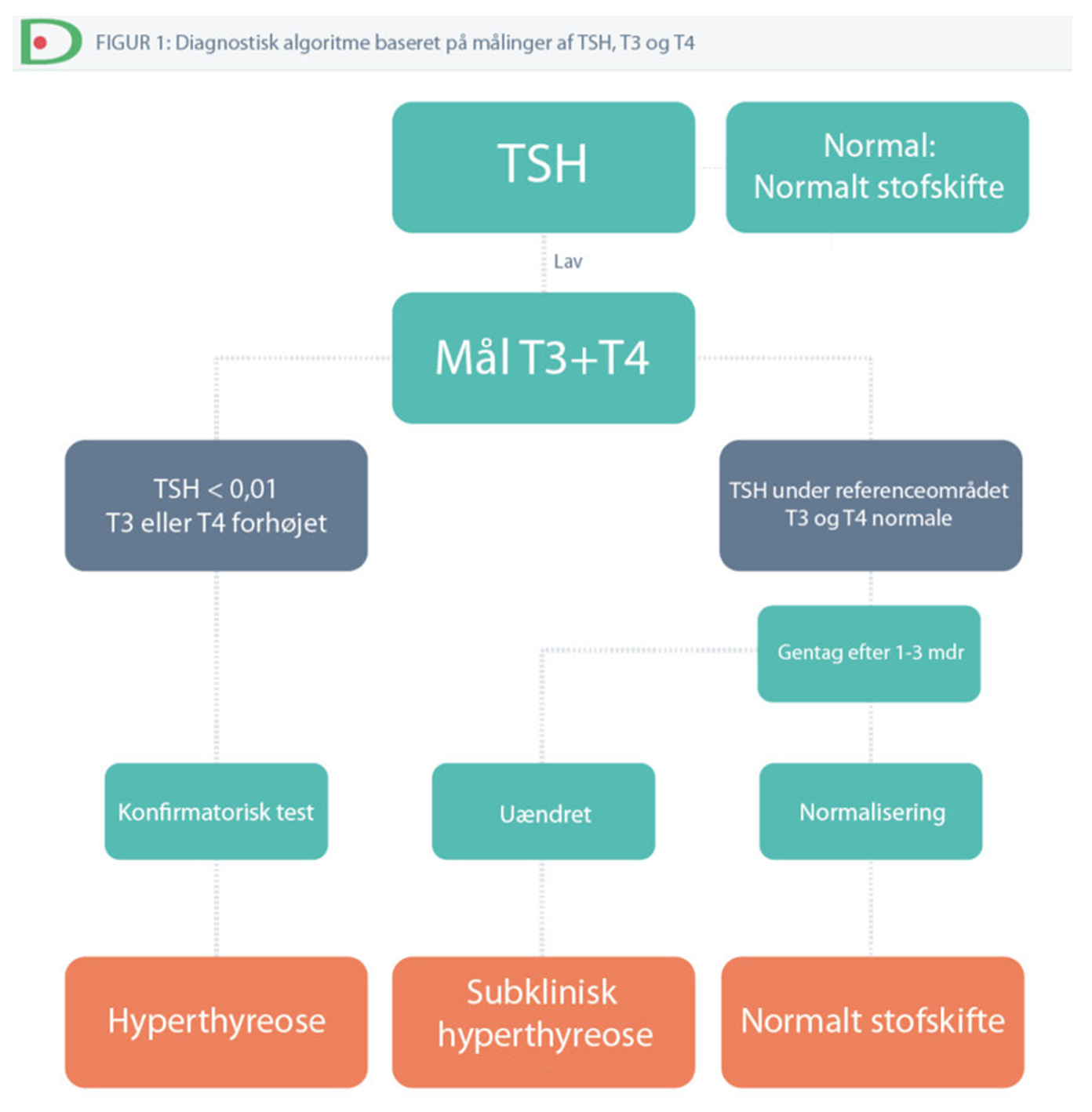
Grundet interferens kan der forekomme falske værdier i nogle assays hvis patient serum indeholder høj koncentration af biotin. Der kan således forekomme falske værdier med lav TSH, høj T4, høj T3, høj TRAb ved højt biotin indtag3. Dette bør mistænkes ved fravær af symptomer hos en patient med indtag af større mængde biotin. Ved mistanke derom anbefales pausering af biotin (ca. 1-3 døgn, T½ = ca. 2-18 timer afhængig af biotin-dosis 4) og kontrol af biokemi.
Symptomer og kliniske fund
Kan være diffuse og variere i sværhedsgrad, bl.a. afhængig af alder og co-morbiditet. Nedenstående er ikke udtømmende, og man behøver ikke have alle symptomer:
Indre uro, nervøsitet, søvnbesvær, koncentrationsbesvær, hukommelsesbesvær, hjertebanken, åndenød, tremor, vægttab, diarré, menstruationsforstyrrelser, varmeintolerans og hedeture, træthed, struma.
Komplikationer
Osteoporose, atrieflimren, hjertesvigt, kognitive deficit samt øget mortalitet.
Udredning
Ved mistanke om stofskiftelidelse måles som screeningsprøve TSH. Såfremt TSH < 0,3 mU/l, så måles der T4 og T3. Patienter henvist med thyrotoksikose udredes med:
- TSH, T4 og T3.
- CRP ved mistanke om thyroidit.
- TSH-receptor antistoffer (TRAb, nogle laboratorier bruger betegnelsen TRAK).
- Evt. thyroideascintigrafi (eller ultralyd) ved negativ TRAb afhængig af lokale retningslinjer.
Såfremt der forligger forhøjet TRAb, og der ikke er palpable knuder i gl. thyroidea kan billeddiagnostik evt. udelades.
Ætiologi
Thyrogen
Autoimmun
- Graves’ sygdom (Diffus toksisk struma)
Non-autoimmun
- Multinodøs toksisk struma
- Solitært toksisk adenom
- HCG-overproduktion (herunder gestationel transient thyrotoksikose, se særskilt NBV)
Betinget af destruktion af glandula thyroidea:
- Subakut thyroiditis (De Quervain), se særskilt NBV
- Stum (=painless) thyroiditis (inklusive postpartum thyroiditis), se særsilt NBV
- Thyroiditis efter radiojodbehandling
Farmakologisk betinget:
- Amiodaron, se særskilt NBV
- Jod excess – såsom røntgen kontrast
- Excessiv thyroideahormon indtagelse (thyrotoxicosis factitia)
- Immunmodulerende stoffer, se særskilt NBV
- Lithium
Sekundær hyperthyroidisme ved hypofyse/hypothalamuslidelser
- TSH-producerende hypofyseadenom (meget sjælden, se særskilt NBV)
Non-thyroidea sygdom
- Svær somatisk eller psykiatrisk sygdom kan medføre påvirket thyroidea funktion – typisk ses primært lavt s-T3, men TSH kan også være supprimeret
Differentialdiagnoser (Tabel 1)
| Graves sygdom |
|
| Multinodøs toksisk struma |
|
| Solitært toksisk adenom |
|
| Subakut thyroidit |
|
| Medikamentel/jod betinget thyroidit |
|
- Subklinisk thyrotoksikose
- Manifest/overt thyrotoksikose
- Thyrotoksisk krise
Graves’ sygdom(Diffus toksisk struma) ICD-10 E05.0:
Synonymer: Diffus toksisk struma, Graves’ sygdom, Mb. Basedow.
Graves’ sygdom er en autoimmun sygdom, hvor forekomsten af antistoffer mod TSH receptoren (TRAb) bevirker forhøjet stofskifte, evt. struma og øjensymptomer – Graves’ Orbitopati, tidl. benævnt thyroidea associeret ophthalmopati (TAO). Se særskilt instruks vedrørende Graves’ Orbitopati.
Behandling 5
- Antithyroid medicin 6
- Radioaktivt jod
- Thyroidektomi
I Danmark er der tradition for medicinsk behandling, som fører til remission hos op til 50-60% af patienterne. Ved sygdomsrecidiv eller patientpræference herfor bør en definitiv behandling med radioaktivt jod eller operation overvejes. Hos ældre med betydende co-morbiditet kan langtidsbehandling med antithyroid medicin overvejes.
Efter ophør med antithyroid behandling er recidiv risikoen størst hos rygere, høj TRAb, initialt svær T3 forhøjelse og stor struma.
Livskvaliteten (QoL) er ofte nedsat hos patienterne som klager over en fornemmelse af ”ikke at være sig selv”, selv når stofskiftet biokemisk er normaliseret. Imidlertid er QoL sammenlignelig ved hver af de tre behandlingsmuligheder 7.
Der udspørges og undersøges specifikt for Graves’ Orbitopati, og patienten oplyses om symptomer herpå (se link), der bør føre til prompte lægekontakt; specielt vedvarende synsnedsættelse, øjensmerter eller påvirket farvesyn.
Ved valg af behandling bør patienten inddrages i fordele og ulemper ved de forskellige regimer.
Symptomatisk behandling
Betablokade giver god og hurtigt indsættende lindring ift hjertebanken, tremor og indre uro og bør overvejes som initiel behandlingen, indtil effekten af den antithyroide medicin sætter ind. Særligt hos ældre patienter med takykardi i hvile eller kendt hjertesygdom.
- Propranolol er førstevalg, dosering 10-40 mg x 4 dagligt. Udtrappes over 1 uge, når patienten er euthyroid.
- Ved kontraindikationer til Propranolol kan Verapamil, vælges i dosering 40-80 mg x 3 dagligt.
- Rygestop tilrådes, da rygning øger risikoen for recidiv og for udvikling af Graves’ Orbitopati.
Antithyroid behandling (ved graviditet se: link til graviditet og thyroidea NBV)
Som udgangspunkt behandles alle patienter initialt med antithyroid medicin.
Vælges i håb om primært at opnå remission, men efterhånden får flere patienter (ved flere recidiver og manglende ønske/mulighed for radioaktivt jod) langvarig behandling i lille dosis, der synes at være sikker 8.
Der behandles med titrerings-regime eller block-replacement-terapi.
Titrerings-regime (monoterapi med antithyroid medicin) foretrækkes ofte pga. lavere antithyroid dosis og dermed mindre risiko for bivirkninger. I begyndelse titreres efter T3-/T4-niveau og når denne nærmer sig øvre reference-grænse sættes dosis ned. TSH er ofte ikke målelig i begyndelsen grundet pituitært delay (lavt eller supprimeret TSH ofte længe efter normaliseret T3 og/eller T4) 9. Endelig kan positivt TRAb i sig selv medfører supprimering af TSH 10;11.
Block-replacement-terapi vælges, når behovet for stabilt stofskiftekontrol vægtes højt, fx ved Graves’ Orbitopati, eller hvis behandling med titrering viser sig vanskelig (svingende stofskifte eller ”skæv profil” med høj T3 og lav T4).
Block-replacement-terapi er kontraindiceret hos gravide.
Ved titreringsregime er førstevalg antithyroid medicin er Thiamazol – pga. lavere risiko for bivirkninger sammenlignet med Propylthiouracil (PTU). Dog således at man hos fertile kvinder bør drøfte graviditetsønske og valg af antithyroid medicin (link til NBV om thyroidea sygdom ved graviditet og infertilitet).
Figur 2: Behandlings-algoritme for Graves´ thyrotoxicosis.
Bivirkninger (listen er ikke udtømmende)
- Kløende hududslæt.
- Artralgi, oftest i proximale fingerled.
- Agranulocytose ca. 1 %, oftest < 100 dage, men kan opstå sent i forløbet: Ved feber eller halssmerter skal pt. pausere Thiamazol og søge læge mhp. kontrol af leukocyt-differentialtælling.
- Leverpåvirkning, oftest cholestatisk: vedvarende mavesmerter, kvalme, anoreksi, icterus, lysfarvet afføring og mørk urin skal føre til lægekontakt mhp. kontrol af leverparametre.
- Pancreatitis 12
Milde bivirkninger herunder hudreaktioner kan oftest tolereres under antihistamin behandling og/eller skift til PTU. Ved alvorlige bivirkninger skiftes til anden behandling end antithyroid medicin.
Patienten skal ved behandlings start informeres om bivirkninger til antihyroid medicin specielt forholdregler vedr. feber/halssmerter.
Der er ikke kryds-allergi mellem thiamazol og PTU, om end en kraftig allergisk reaktion giver en større risiko for allergi mod begge præparater.
Bivirkningerne opstår hyppigst ved høj dosis men kan også ses ved lav dosering.
Målet for behandlingen er, at stofskiftet ligger højt i normalområdet, dvs. T4 i normalområdet og TSH nederst i normalområdet, når denne atter er målbar (ofte først efter måneder).
Det er helt centralt at undgå TSH forhøjelse, da Graves’ Orbitopati herved kan forværres eller fremprovokeres.
Kontrol efter f.eks. 2- 4 uger, og derefter afhængig af forløbe.
Behandlingsvarighed er vanligvis 12-18 måneder. Ved titrerings-regime vil aktuelle dosis af antithyroid medicin og evt. niveau af TRAb være vejledende for tidspunktet for ophør af behandling. Block-replacement-terapi kan seponeres umiddelbart eller udtrappes.
Ved normalisering af TRAb og lav dosis anti-thyroid medicin, kan behandlingen umiddelbart seponeres. TRAb kan ikke altid forventes normaliseret da neutrale antistoffer kan være tilstede, og såfremt antistofferne efter at have været faldende har opnået et plateau, kan behandling forsøges seponeret.
TRAb kan være fluktuerende mellem overvejende stimulerende antistoffer (klassisk Graves´ thyrotoxicosis) og blokerende (autoimmun hypothyroidisme) 13;14.
Opfølgning efter endt behandling:
Kontrol f. eks. efter 3 og 6 uger, 3, 6 og 12 måneder. Patienten afsluttes til egen læge med råd om
- Praktiserende læge kan kontrollere stofskifte derefter (x1-2 årligt i et par år). Patienten opfordres til på at søge lægen ved nytilkomne symptomer foreneligt med forhøjet stofskifte
- Lægehenvendelse ved øjensymptomer
- Kontrol af stofskiftet både før og ved påvist graviditet (se i øvrigt NBV graviditet og thyroideasygdom)
Overvejes når medicinsk behandling ikke tåles, ved recidiv efter medicinsk behandling eller som initial behandling ved ønske om definitiv behandling, fx ved stor struma. Behandlingens succeskriterium er at gøre patienten eu- eller hypothyroid. Den umiddelbare effekt af jodbehandling ved Graves’ varierer, idet der både kan ses hurtig udvikling af hypothyroidisme, men også længerevarende stigning i stofskiftet med samtidig stigning i TRAb.
Der henvises til selvstændig NBV om radioaktiv jodbehandling, hvor kontraindikationer (graviditet, amning, manglende compliance til strålehygiejniske forholdsregler, aktiv og moderat til svær Graves’ Orbitopati, graviditetsønske indenfor få måneder), bivirkninger, ulemper (behandlingssvigt, behov for substitutionsbehandlings med L-thyroxin, udvikling/forværring af Graves’ Orbitopati) samt behandling og kontrol forløb beskrives.
Vælges ved ønske om hurtig og endelig stofskiftekontrol, særligt ved stor symptomgivende struma, gentagne recidiver, intolerance for medicinsk behandling, patient præference eller moderat til svær Graves’ Orbitopati. Der anbefales total thyroidektomi mhp. at undgå recidiv. Der er derfor efterfølgende livslangt behov for L-thyroxin. Operation er mere effektivt end radioaktiv jodbehandling, idet der ikke opstår recidiv af hyperthyroidisme.
Der forbehandles med antithyroid medicin og evt. betablokker. D-vitamin mangel korrigeres præoperativt, da risiko for post-operativ hypocalcæmi reduceres. Der stiles så vidt mulig efter normalisering af stofskiftet før operation. Er dette ikke muligt pga. f.eks. medicinallergi, stiles mod betablokering (evt. anvendelse af verapamil) til puls ca. 80. Præoperativt kan peroral kalium-iodid mikstur anvendes mhp. at dæmpe stofskiftet og hæmme kirtlens vaskularisering.. Dosis f.eks. kalium-jodid mikstur, 20 mg/ml, 10 ml dagligt eller tablet kalium-jodid 200 mg i 10 dage forud for operation.
Betydende co-morbiditet, graviditet (relativ) (se NBV graviditet og thyroideasygdomgraviditet og thyroideasygdom).
Per- og postoperativ blødning, infektion, n. recurrens parese (ca. 1 %), hypoparathyroidisme (5 % – 10 %)
Indstilling af substitutionsbehandling og kontrol af calcium efter behov. Fertile kvinder skal instrueres i behovet for kontrol af stofskiftet inklusiv TRAb før og under graviditet (link til NBV).
![]()
Toksisk multinodøs struma ICD-10: E05.2
Synonymer
Knude-struma med højt stofskifte, Toxic multinodular goitre, Plummers disease.
Tilstanden skyldes, at der i glandula thyroidea opstår autonomt fungerende celler. Sådanne celler har typisk en aktiverende somatisk mutation i TSH receptoren, hvilket kan medføre både struma og hyperthyroidisme. Jodmangel er en væsentlig risikofaktor for opståen af autonomi. Tilstanden er oftest langsomt progredierende og livslang.
Symptomerne på hyperthyroidisme er ofte milde, eventuelt fraværende. Der kan være strumarelaterede symptomer som globulusfornemmelse, synkebesvær eller kosmetiske gener. Struma er ofte med sideforskel og palpable knuder.
Hyperthyroidisme er forbundet med risiko for atrieflimren og osteoporose og er af denne grund behandlingskrævende uanset eventuel manglende symptomatologi.
Se under hyperthyroidisme og differentialdiagnostiske overvejelser.
Der findes tre behandlingsformer nævnt i prioriteret rækkefølge (+ evt symptom behandling se under Graves’ sygdom) 5:
131Jod optages fortrinsvis i autonome thyrocytter, der uger til måneder efter behandling ødelægges. Ved radioaktiv jodbehandling er effekten på hyperthyroidisme langsomt indsættende, idet ca. 50 % af patienterne er euthyroide efter 3 mdr. og 80 % efter 6 mdr. Effekt på struma er ofte varierende (gennemsnitligt 40 % – 50 % struma reduktion) og mere langsomt indsættende (ændringer kan stadig ses 1-2 år efter) 15. Risiko for hypothyroidisme hos ca. 30% af patienterne i løbet af de første 5 år.
Hos ældre eller hjertesyge patienter anvendes antithyroid medicin forud for radioaktiv jodbehandling for at opnå hurtig stabilisering af stofskiftet og for at undgå opblussen umiddelbart efter radioaktiv jodbehandling. Denne behandling fortsættes i en kort periode efter jodbehandlingen.
Der henvises i øvrigt til selvstændig NBV om radioaktiv jodbehandling.
Kontraindikationer og komplikationer og opfølgning
Se selvstændig NBV om radioaktiv jodbehandling.
Ved stor struma og især ved kompression af trachea foretrækkes operativ behandling. Der bør udføres total (nær-total) thyroidektomi.
Komplikationer og opfølgning
Se under Graves’ Sygdom/operation.
3) Medicinsk antithyroid behandling.
Denne behandling er grundet sygdommens naturhistorie livslang. Lav dosis antithyroid behandling er en sikker behandling8 og kan i princippet anvendes til alle, måske specielt til ældre eller svagelige patienter.
Opfølgning
Regelmæssig kontrol af TSH og T4 mhp. behandlingsjustering, fx hver 8 uge. Efter stabilisering kan patienten afsluttes til egen læge med kontrol hver 3.-6. måned. Behandling og kontrol er livslang.
Supplerende:
Scintigrafisk ”kolde knuder” ved Toksisk multinodøs struma udredes og behandles i henhold til vejledning for dette (se NBV udredning af knuden i gl. thyroidea).
Patienter med Graves’ og samtidig toksisk multinodøs struma behandles primært som Graves sygdom (ses hos ca 5% af patienter med skintigrafisk nodøs struma) (for behandling, se under Graves afsnittet). Hvis antithyroid medicin ikke kan udtrappes eller der opstår recidiv vælges efterfølgende Radioaktiv jodbehandling eller kirurgi.
![]()
Solitært toksisk adenom ICD-10: E05.1
Se afsnittet om multinodøs toksisk struma for baggrunden for opståen af autonomi. Solitær toksisk adenom adskiller sig fra multinodøs toksisk struma, ved at der kun er et enkelt adenom med autonom hormon produktion. Ligesom multinodøs toksisk struma er tilstanden oftest langsomt progredierende og livslang. Forekomsten af Solitær toksisk adenom er ikke relateret til jodstatus.
Oftest symptomfattig, men alle symptomer på hyperthyroidisme kan ses.
Se under hyperthyroidisme samt differentialdiagnostiske overvejelser.
Se tabel 1.
Som multinodøs toksisk struma.
Radioaktivt jod er normalt den anbefalede behandling. Effekten på hyperthyroidismen er bedre for Solitært toksisk adenom end ved multinodøs toksisk struma, idet der er en 75 % respons rate efter 3 mdr. I Danmark bruges relativt lave 131I doser, og behandlingskrævende hypothyroidisme ses hos cirka 10 % 5 år efter radiojod behandling16. Risikoen for hypothyroidisme er størst hos ældre og hos patienter, der ikke havde supprimeret TSH før behandling. Se selvstændig NBV om radioaktiv jodbehandling.
Medikamentel antithyroid behandling benyttes efter samme principper som ved multinodøs toksisk struma. Se afsnittet herfor.
Ved kirurgi foretages hemithyroidektomi.
Scintigrafisk ”kolde knuder” udredes i henhold til vejledningen herfor (NBV: Udredning af knuden i gl. thyroidea), og før man eventuelt vælger Radioaktiv jodbehandling.
Subklinisk thyrotoksikose
Subklinisk thyrotoksikose er ikke en selvstændig sygdomstilstand men hentyder blot til den biokemiske sygdomsgrad. Ætiologi og udredning er derfor som for thyrotoksikose generelt.
Det er en biokemisk diagnose, der stilles, når TSH ved gentagne målinger er under referenceområdet og T4 og T3 er normale. Typisk vil FT4 og FT3 dog ligge højt i normalområdet.
Det forudsættes, at patienten ikke er svært kronisk eller akut syg (non-thyroidal illness).
Prævalensen af subklinisk thyrotoksikose afhænger af alder, køn og jodindtaget. Subklinisk thyrotoksikose rammer 10 % af befolkningen i jodmangel områder og ca. 1% i jodsufficiente områder 17. Tilstanden forekommer hyppigere med stigende alder.
Anden sygdom eller farmakologisk behandling, fx med glukocorticoider, kan give et lignende biokemisk billede. Se i øvrigt tabel 1.
Oftest asymptomatisk, men forbundet med risiko for komplikationer såsom atrieflimren og osteoporose. Patienterne bør udredes for dette.
Indikation for behandling er omdiskuteret. Nyere data (inklusiv danske) taler for mere aktiv behandling af subklinisk hyperthyreose, idet der er påvist øget mortalitet og kardiovaskulær morbiditet 18-21.
Der er styrket indikation for behandling ved gentagne TSH-målinger < 0.1 mU/l uanset evt. risikofaktorer eller symptomer. Ved TSH 0.1-0.3 mU/l bør behandling overvejes ved symptomer eller tilstedeværelse af en eller flere risikofaktorer: alder > 65 år, osteoporose, hjertesygdom inkl. atriflimmer.
Valg af behandlingsmodalitet afhænger af ætiologien.
Ubehandlede bør kontrolleres hver 6-12 mdr – kan følges hos egen læge.
Thyrotoksisk krise
Sjælden, livstruende tilstand med svære thyrotoksiske symptomer. De klassiske symptomer er takycardi/arytmitendens, feber og cerebral påvirkning. Herudover kan der ses diarré, kvalme, opkastninger, dehydrering, kardiel inkompensation, tendens til tromboembolisme og cirkulatorisk kollaps. Tilstanden er ofte præcipiteret af anden sygdom, traume, operation eller fødsel hos patient med uerkendt eller insufficient behandlet hyperthyroidisme.
Diagnosen baseres på kliniske fund, idet de perifere thyroideahormoner ikke nødvendigvis findes svært forhøjede.
Behandlingen forgår ofte på intensiv afdeling og under telemetri.
Antithyroid behandling
Propylthiouracil (PTU) foretrækkes da PTU i høje doser hæmmer den perifere omdannelse af T4 til T3.
Der gives en bolus på 400 mg PTU og herefter 200 mg hver 4.time (knuste tabletter opslemmes i vand og gives peroralt eller i ventrikelsonde). Alternativt kan vælges PTU til iv-dosering. Hvis PTU er kontraindiceret, kan imidazolderivat anvendes.
Jodidindgift
De første 2 døgn gives én time EFTER hver PTU dosis 5 ml Natrium-jodid 50mg/ml iv. Alternativt kan anvendes tbl./mikstur Kalium-jodid 400mg.
Betablokade
Tbl. Propranolol gives i døgndoser på 120-240 mg fordelt på 4-6 doser. Eventuelt gives 2 mg propranolol som langsom iv injektion med 4-6 timers interval under monitorering.
Glukocorticoider
Hydrokortison (Solu-Cortef) 100 mg x 3-4 iv/døgn i 2-3 døgn.
Øvrig behandling:
Hyperpyreksi: Paracetamol og evt. mekanisk afkøling. På sigt overvejes thyroidektomi.
Væskesubstitution
Antibiotika anvendes på vide indikationer.
Yderligere intensivt understøttende terapi afhængig af symptomatologi og udløsende årsag.
Tovholder
Seneste revision: Oktober 2021
Næste revision: Oktober 2024
Øvrige forfattere
Anne Lene Dalkjær Riis
Birte Nygaard
Diana Lerkevang Grove Laugesen’
Juliana Frohnert Hansen
Jesper Karmisholt
Nils Knudsen
Vedr. interesse konflikter – se venligt: link
Referencer
- Bulow P, I, Laurberg P, Knudsen N, Jorgensen T, Perrild H, Ovesen L et al. Increase in incidence of hyperthyroidism predominantly occurs in young people after iodine fortification of salt in Denmark. J.Clin.Endocrinol.Metab 2006;91:3830-4.
- Carle A, Pedersen IB, Knudsen N, Perrild H, Ovesen L, Rasmussen LB et al. Epidemiology of subtypes of hyperthyroidism in Denmark: a population-based study. Eur.J.Endocrinol. 2011;164:801-9.
- Sharma A, Baumann NA, Shah P. Biotin-Induced Biochemical Graves Disease: A Teachable Moment. JAMA Intern.Med 2017;177:571-2.
- Li D, Radulescu A, Shrestha RT, Root M, Karger AB, Killeen AA et al. Association of Biotin Ingestion With Performance of Hormone and Nonhormone Assays in Healthy Adults. JAMA 2017;318:1150-60.
- Bahn RS, Burch HB, Cooper DS, Garber JR, Greenlee MC, Klein I et al. Hyperthyroidism and other causes of thyrotoxicosis: management guidelines of the American Thyroid Association and American Association of Clinical Endocrinologists. Endocr.Pract. 2011;17:456-520.
- Abraham P, Avenell A, Watson WA, Park CM, Bevan JS. Antithyroid drug regimen for treating Graves’ hyperthyroidism. Cochrane.Database.Syst.Rev. 2004;CD003420.
- Abraham-Nordling M, Törring O, Hamberger B, Lundell G, Tallstedt L, Calissendorff J et al. Graves’ disease: a long-term quality-of-life follow up of patients randomized to treatment with antithyroid drugs, radioiodine, or surgery. Thyroid 2005;15:1279-86.
- Azizi F, Takyar M, Madreseh E, Amouzegar A. Treatment of Toxic Multinodular Goiter: Comparison of Radioiodine and Long-Term Methimazole Treatment. Thyroid 2019;29:625-30.
- Yu H,.Farahani P. Thyroid stimulating hormone suppression post-therapy in patients with Graves’ disease: a systematic review of pathophysiology and clinical data. Clin.Invest Med 2015;38:E31-E44.
- Brokken LJ, Wiersinga WM, Prummel MF. Thyrotropin receptor autoantibodies are associated with continued thyrotropin suppression in treated euthyroid Graves’ disease patients. J Clin.Endocrinol.Metab 2003;88:4135-8.
- Chung YJ, Lee BW, Kim JY, Jung JH, Min YK, Lee MS et al. Continued suppression of serum TSH level may be attributed to TSH receptor antibody activity as well as the severity of thyrotoxicosis and the time to recovery of thyroid hormone in treated euthyroid Graves’ patients. Thyroid 2006;16:1251-7.
- Brix TH, Lund LC, Henriksen DP, Folkestad L, Bonnema SJ, Hallas J et al. Methimazole and risk of acute pancreatitis. Lancet Diabetes Endocrinol. 2020;8:187-9.
- Wong M,.Inder WJ. Alternating hyperthyroidism and hypothyroidism in Graves’ disease. Clin.Case.Rep. 2018;6:1684-8.
- Kasagi K, Hidaka A, Endo K, Miyamoto S, Takeuchi R, Misaki T et al. Fluctuating thyroid function depending on the balance between stimulating and blocking types of TSH receptor antibodies: a case report. Thyroid 1993;3:315-8.
- Nygaard B, Hegedus L, Gervil M, Hjalgrim H, Soe-Jensen P, Hansen JM. Radioiodine treatment of multinodular non-toxic goitre. BMJ 1993;307:828-32.
- Nygaard B, Hegedüs L, Nielsen KG, Ulriksen P, Hansen JM. Long-term effect of radioactive iodine on thyroid function and size in patients with solitary autonomously functioning toxic thyroid nodules. Clin.Endocrinol.(Oxf) 1999;50:197-202.
- Laurberg P, Pedersen KM, Hreidarsson A, Sigfusson N, Iversen E, Knudsen PR. Iodine intake and the pattern of thyroid disorders: a comparative epidemiological study of thyroid abnormalities in the elderly in Iceland and in Jutland, Denmark. J.Clin.Endocrinol.Metab 1998;83:765-9.
- Biondi B, Bartalena L, Cooper DS, Hegedus L, Laurberg P, Kahaly GJ. The 2015 European Thyroid Association Guidelines on Diagnosis and Treatment of Endogenous Subclinical Hyperthyroidism. Eur.Thyroid J. 2015;4:149-63.
- Wiersinga WM. Guidance in Subclinical Hyperthyroidism and Subclinical Hypothyroidism: Are We Making Progress? Eur.Thyroid J. 2015;4:143-8.
- Kahaly GJ, Bartalena L, Hegedus L, Leenhardt L, Poppe K, Pearce SH. 2018 European Thyroid Association Guideline for the Management of Graves’ Hyperthyroidism. Eur.Thyroid J. 2018;7:167-86.
- Selmer C, Olesen JB, Hansen ML, von Kappelgaard LM, Madsen JC, Hansen PR et al. Subclinical and overt thyroid dysfunction and risk of all-cause mortality and cardiovascular events: a large population study. J.Clin Endocrinol.Metab 2014;99:2372-82

