Hvad omfatter denne NBV
- Udredning og behandling af hypothyroidisme hos gravide
- Udredning og behandling af thyrotoksikose hos gravide
- Udredning og behandling af gestationel transient thyrotoksikose
- Thyroideafunktionstest og antistoffer under graviditet
- Thyroideasygdom og infertilitet
Hvad omfatter denne NBV ikke
- Behandling af thyroideacancer hos gravide
- Udredning og behandling af struma og knuder i glandula thyroidea hos gravide (link til NBV knuden thyroidea)
- Udredning og behandling af postpartum thyroiditis (link til NBV Thyroidit)
- Udredning og behandling af thyroideasygdom hos gravide som følge af sygdom i hypothalamus og/eller hypofysen
- Infertilitet i forbindelse med graviditetstab efter 22 gestationsuge.
Diagnosekoder (ICD)
- O992C Thyrotoksikose som komplicerer graviditet, fødsel eller barselsperiode
- O992B Hypothyroidisme som komplicerer graviditet, fødsel eller barselsperiode
Denne NBV ligger i tæt forlængelse af gældende amerikanske og europæiske guidelines; men fraviger disse, hvor særlige danske forhold gør sig gældende og er aktuelt opdateret i henhold til nye data, der også forventes at blive implementeret i internationale guidelines.
Screening for thyroideasygdom ved graviditetsønske eller påvist graviditet
Der er ikke evidens for at indføre generel screening for stofskiftesygdom.
Screening ved måling af TSH og evt. thyroideaantistoffer hos gravide og kvinder med graviditetsønske anbefales ved nedenstående risikofaktorer. (se note 1 + 2)
- Kvinder med tidligere påvist thyrotoksikose, hypothyroidisme eller postpartum thyroiditis samt kvinder, der tidligere har gennemgået kirurgisk indgreb i gld. thyroidea eller har fået radiojod behandling.
- Kvinder med en familieanamnese med thyroideasygdom
- Kvinder med struma
- Kvinder med påviste thyroideaantistoffer
- Kvinder med symptomer eller kliniske tegn på thyroideadysfunktion
- Kvinder med type 1 diabetes
- Kvinder med andre autoimmune sygdomme
- Som led i udredningen af kvinder med infertilitet (inkl. recidiverende spontan abort)
- Kvinder, der tidligere er bestrålet i hoved- eller halsregionen
- Kvinder, der tidligere har født for tidligt
- Kvinder med BMI > 40
Note1: I ATA guideline anføres endvidere punktet: alder > 30 år. Dette er ikke medtaget, idet det vurderes, at hvis dette punkt skulle inddrages, så ville det være identisk med, at ALLE gravide skulle screenes, da denne aldersgruppe udgør langt størstedelen af gravide.
Note: 2 Målingerne bør foretages inden graviditet eller ved første graviditetsbesøg. Der bør anvendes trimester-specifikke referenceværdier (se afsnit vedr. trimesterspecifikke referenceintervaller). Ved TSH uden for referenceinterval skal øvrige thyroideavariable altid måles.
Thyroideafunktionstest/referenceintervaller og antistoffer under graviditet
Fysiologiske ændringer i thyroideafunktionen under graviditet.: Graviditetshormonet HCG har en thyrotrop effekt, der i første trimester medfører en fysiologisk stigning i thyroideahormoner, og ved negativt feedback et tilsvarende fald i TSH. Denne effekt aftager i andet og tredje trimester. TSH falder derfor i første trimester for at stabilisere sig i andet og tredje trimester.
Det stigende østrogenniveau inducerer øgning af TBG, hvilket øger totalkoncentrationen af T3 og T4, der i andet og tredje trimester ligger højere end hos ikke-gravide. Måling af frie thyroideahormoner under graviditet er stærkt påvirkede af graviditetsændringer og man må være påpasselig med at tolke disse. Andre faktorer, der påvirker den maternelle thyroideafunktion, er øget renal jodclearance og placental dejodinering af thyroideahormoner. Thyroideaautoimmunitet vil generelt forbedres under graviditet. Disse graviditetsbetingede ændringer i thyroideahormonproduktion og omsætning nødvendiggør trimesterspecifikke referenceintervaller (1,23,24). (gemmes bag et link)
Den graviditetsbetingede immunsuppression bevirker, at thyroidea-autoantistoffer (TRAb, anti-TPO og Tg-antistoffer) falder under graviditet
Afhængigt af prægravide koncentrationer kan antistofniveauerne blive umålelige i 3. semester for atter at stige postpartum med risiko for thyroidea dysfunktion. Anti-TPO er ikke i sig selv vævsdestruerende, men er et epifænomen for underliggende cellulær autoimmun thyroiditis. De har derfor ingen betydning for fosteret eller det nyfødte barns thyroideafunktion. Kvinder med anti-TPO har øget risiko for at udvikle hypothyroidisme under graviditet (25), ligesom de har en øget risiko for post partum thyroiditis. Det er endnu uafklaret, hvorvidt forekomst af thyroglobulin antistoffer kan have relevans for graviditetens forløb og udfald (26). Høje niveauer af TRAb kan i sjældne tilfælde forårsage struma og thyrotoksikose hos fostret, selv om moderen er euthyroid og ubehandlet (se afsnit ”Planlægning af graviditet hos patienter med Graves´ thyrotoksikose”). TRAb positive kvinder risikerer opblussen af thyrotoksikose post partum. (Gemmes bag et link)
Referenceintervaller for danske kvinders thyroideafunktion under graviditet:
Der foreligger flere studier af thyroideafunktion hos raske gravide danske kvinder (27-32). Danske kvinders TSH ligger højere end kvinder fra jodsufficiente områder, herunder USA, hvorfor referenceintervaller herfra ikke ukritisk kan benyttes i Danmark.
Kliniske rekommandationer:
- Trimesterspecifikke og metodespecifikke referenceintervaller tilstræbes ved diagnostik og behandling af thyroideadysfunktion under graviditet (1,33).
- Såfremt det ikke er muligt at etablere egne referenceintervaller for gravide, og der ikke foreligger tidligere målinger hos den enkelte gravide til sammenligning, anvendes TSH 0,1-3,5 i 1. trimester og 0,3-3,5 i 2. og 3. trimester, alternativt kan 0,8 mIU/l trækkes fra laboratoriets ikke-gravide-reference-interval.
- Total T4 og total T3 kan ved mangel på laboratoriespecifikke referenceintervaller fortolkes ud fra ikke-gravides referenceinterval gange 1,5 i 2. og 3. trimester.
- Frit T4 og frit T3 estimater ved automatiserede metoder varierer betydeligt mellem laboratorier og bør derfor altid måles på samme laboratorium ved monitorering af gravide*. Bør derfor tolkes med varsomhed og kendskab til metoderne.
- Hos kvinder i behandling for thyroideasygdom bør både totale og frie hormoner analyseres og fortolkes under hensyntagen til de dynamiske ændringer i thyroideahormonproduktion og -omsætning under graviditet samt forventelig forsinkelse til opnåelse af steady state ved dosisændringer.
* Fodnote: De frie hormonmålinger kan være behæftet med direkte fejl som følge af de øgede graviditetsbetingede bindingsproteiner. Dette kan der ikke korrigeres for. Sikrest er at måle både total T4 og T3 samt frit t4 og frit t3 estimat
Forslag til trimester specifikke referenceintervaller, hvor egne trimester- og laboratoriespecifikke referenceintervaller mangler.
(Baseret på danske data med geografiske forskelle. Bør anvendes med påpasselighed)
| 1. Trimester | 2. Trimester | 3. Trimester | |
| TSH | 0,1-3,5 | 0,3-3,5 | 0,3-3,5 |
| Eller fratræk 0,8 mIU/L fra laboratoriets reference-interval for ikke-gravide | |||
| FT4* | Ekstremt metodeafhængigt – anvend yderst varsomt | ||
| FT3* | Ekstremt metodeafhængigt – anvend yderst varsomt | ||
| TT4* | Ikke-gravides referenceinterval multipliceret med 1,5 kan anvendes | ||
| TT3* | Ikke-gravides referenceinterval multipliceret med 1,5 kan anvendes | ||
* Fodnote: De frie hormonmålinger kan være behæftet med direkte fejl som følge af de øgede graviditetsbetingede bindingsproteiner. Dette kan der ikke korrigeres for. Sikrest er at måle både total T4 og T3 samt frit t4 og frit t3 estimat
Hypothyroidisme under graviditet
Definitioner:
Manifest hypothyroidisme under graviditet: TSH > 3,5 og T4 < den estimerede nedre trimesterspecifikke referenceværdi (link til afsnit vedr. thyroideafunktionstest) (1,2).
Subklinisk hypothyroidisme under graviditet: TSH > 3,5 og T4 inden for den estimerede trimesterspecifikke referenceværdi (link til afsnit vedr. thyroideafunktionstest) (1,2).
Forekomst:
I Danmark er prævalensen af fertile kvinder med henholdsvis manifest hypothyroidisme 0,6 – 1 % og subklinisk hypothyroidisme mellem 3 – 5,3 % (3,4).
Ætiologi:
Kronisk autoimmun thyroiditis er i Danmark den hyppigste årsag til hypothyroidisme under graviditeten og thyroidea peroxidase antistoffer (anti-TPO), thyroglobulin antistoffer (Tg-antistoffer) og sjældnere TSH-receptor antistoffer (TRAb), findes hos 5-15 % af alle kvinder i den fertile alder (4-6). Herefter følger iatrogent induceret hypothyroidisme (radiojod behandling/strumektomi), forbigående hypothyroidisme og medikamentelt udløst hypothyroidisme (fx antithyroid medicin, litium, amiodaron samt excessiv jodindtagelse) (5;7).
Symptomer og kliniske fund: Link til NBV hypothyroidisme (8,9).
Prognose:
Der er en sammenhæng mellem hypothyroidisme og nedsat fertilitet, øget abortrisiko samt reduceret udvikling af den føtale hjerne.
Hos gravide kvinder uden kendt thyroideasygdom og målt TSH > 3,5 < 6, anbefales genmåling indenfor 14 dage, idet et studie af danske gravide har vist lav overensstemmelse mellem første og anden måling ved TSH < 6. Ved TSH > 6 i første måling havde samtlige kvinder fortsat forhøjet TSH ved anden måling.(10)
Diagnose og udredning ved nydiagnosticeret hypothyreose under graviditet:
- Hos gravide kvinder uden kendt thyroideasygdom og med TSH < 6 samt T4 indenfor det trimesterspecifikke referenceområde, anbefales måling af TSH/T4 gentaget indenfor 14 dage sammen med måling af anti-TPO.
Hvis TSH fortsat >3,5, da behandles med levothyroxin (LT4) og henvises til endokrinolog. Hvis anti-TPO er positiv men TSH < 3.5, da følges patienten med TSH måling under graviditeten af læge.
- Ved TSH > 6 anbefales altid at påbegynde behandling med LT4, idet ovennævnte studie samtidig viste at alle gravide med TSH > 6 ved første måling, også havde forhøjet TSH ved anden måling (10).
Kliniske rekommandationer:
- Alle gravide med nedsat thyroideafunktion skal så tidligt i forløbet som muligt henvises til endokrinolog for at sikre optimal opfølgning og behandling af den maternelle thyroideafunktion under og efter graviditeten.
- Hypothyroidisme under graviditet behandles altid med LT4, og anvendelse af liothyronin, kombinationspræparater inklusive ekstrakter fra dyre-skjoldbruskkirtler, frarådes*.
- Hos gravide med nydiagnosticeret hypothyroidisme startes behandling snarest muligt, og der stiles mod TSH < 3,5
- Abort tilrådes generelt ikke; derimod tilrådes hurtig normalisering af stofskiftet. (1)
- Nyere forskningsresultater tyder på, at LT4-behandling opstartet hos kvinder med TSH mellem 2,5 mIU/L og normal øvre reference grænse under graviditet kan medføre risici i form af præeklampsi og for tidlig fødsel, mens en gavnlig effekt i form af reduktion af abortrisiko kun opnås hos kvinder med TSH > 4,0 mIU/L (10,12).
- Hos patienter med kendt hypothyoidisme før graviditeten anbefales LT4 dosis justeret allerede ved planlægning af graviditet for at imødekomme det fysiologisk betingede øgede T4 behov først i graviditeten og med henblik på at opnå TSH < 2,5 mIU/L. Under graviditeten stiles efterfølgende mod TSH < 3,5.
- Kontrol af TSH og T4 hver 4. til 6. uge under graviditeten anbefales
. - Ved stabilt TSH < 3,5 er der ikke behov for kontrol efter uge 30.
- Trimester-specifikke reference-intervaller anbefales benyttet. Hvis disse ikke foreligger, anbefales øvre grænse for TSH på < 3,5 mIU/L (se afsnit vedr. thyroideafunktionstest).
- Euthyroide gravide, med påvist anti-TPO anbefales via læge at få målt TSH hver 4. til 6. uge frem til uge 30. Hvis TSH > 3,5 påbegyndes behandling og pt henvises til endokrinologisk opfølgning.
*Fodnote: Der foreligger ikke randomiserede kliniske forsøg som undersøger behandlingen af gravide med liothyronin. Behandling af klinisk hypothyroidisme med levothyroxin anses for at være så sikkert og effektivt, at det ville være uetisk at randomisere gravide med hypothyroidisme til nogen anden behandling. Desuden tyder patofysiologiske dyrestudier på, at T3 ikke passerer placenta, medførende risiko for føtal hypothyroidisme ved kombinationsbehandling (11).
Behandling
- Hos gravide med nydiagnosticeret manifest hypothyroidisme:
Det anbefales at begynde behandlingen med 100 mikrogram LT4 dagligt. Dosis titreres i løbet af 2 til 4 uger op til 2,0-2,4 mikrogram/kg legemsvægt/dag. Herefter justeres dosis i henhold til TSH og T4. Ved TSH > 20 mIU/L kan dosis øges til 200 mikrogram dagligt i løbet af få dage. - Hos gravide med nydiagnosticeret subklinisk hypothyroidisme:
Det anbefales at begynde behandlingen med 50 mikrogram LT4 dagligt. Herefter justeres dosis i henhold til TSH og T4 - Hos gravide i behandling med levothyroxin før graviditet:
Det anbefales at øge LT4 dosis med ca. 25% så snart graviditeten påvises. Såfremt stofskiftet ikke er velbehandlet, øges dosis yderligere. Alternativt tages nye blodprøver så snart graviditeten påvises og LT4 dosis justeres herefter afhængigt af TSH og gestationsuge. Der forventes et gradvist øget substitutionsbehov fra gestationsuge 8 til 16. Overbehandling (TSH < 0,01) bør undgås. - Hos euthyroide gravide med påviste anti-TPO:
Det anbefales, at den gravide via læge får målt TSH ca hver 6 uge. Såfremt TSH under graviditeten måles > 3,5, startes behandling med LT4 50 mikroram x 1 dagligt og patienten henvises til endokrinologisk opfølgning.
Visitation
Behandling af gravide med subklinisk eller manifest hypothyroidisme varetages altid af endokrinolog.
Observation af euthyroide gravide med påviste anti-TPO varetages af læge
Flowdiagram – behandling/kontrol indikation efter graviditet er påvist:
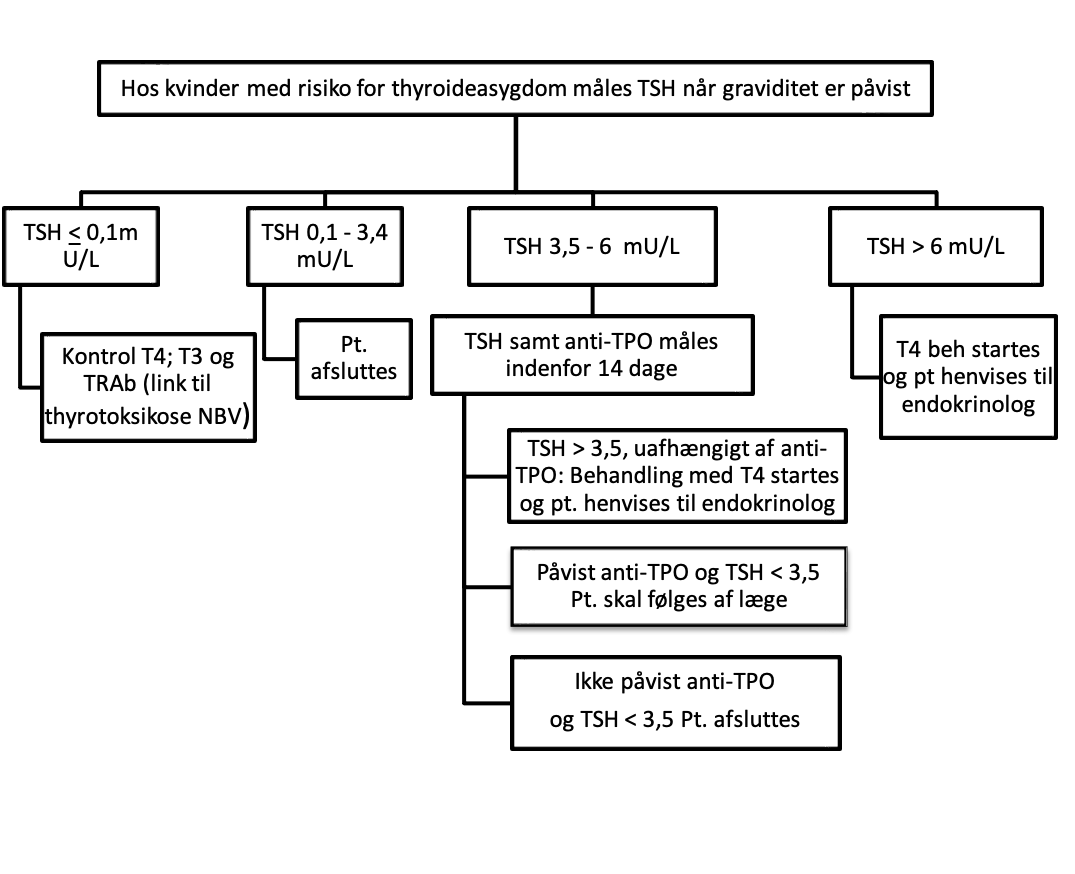
* T4: thyroxin ** T3: Triiodothyronine *** TRAb: thyroidea receptor antistoffer **** anti TPO: Thyroideaperoxidase antistoffer ***** LT4: levothyroxin
Behandling efter endt graviditet:
Hos patienter i LT4 behandling forud for graviditet reduceres dosis til den samme dosis som før graviditet dagen efter endt graviditet (fødsel eller abort).
Ved nydiagnosticeret manifest hypothyroidisme under graviditet foreslås, LT4 dosis reduceret dagen efter fødsel til ca. 50% af slut dosis, og at TSH og T4 kontrolleres hver 4 til 6. uge med henblik på evt. justering af LT4 dosis.
Ved subklinisk hypothyroidisme seponeres/reduceres LT4 dosis umiddelbart postpartum og TSH og T4 kontrolleres af læge efter 4 – 8 uger. Dette kan evt. planlægges i forbindelse m barnets 5-ugers undersøgelse eller patientens egen 8 ugers kontrol post-partum. Det anbefales endvidere at kontrollere stofskiftet postpartum ved symptomer, idet der for denne patientgruppe er øget risiko for postpartum thyroiditis. (link til NBV thyroiditis)
Visitation:
Nydiagnosticeret manifest hypothyroidisme under graviditet følges post-partum af endokrinolog indtil TSH er i niveau.
Nydiagnosticeret subklinisk hypothyroidisme under graviditet kontrolleres post-partum af læge
Thyrotoksikose under graviditet
Definition: Supprimeret TSH < 0,01 kombineret med forhøjet T4/T3 (se afsnit vedr. graviditetsspecifikke referenceintervaller)
Forekomst: Thyrotoksikose ses i op til 3 % af alle graviditeter.
Ætiologi:
| Årsag | Ætiologi |
| Gestationel transient thyrotoksikose (GTT) | (Relativ hyppig: ca 12-1300 ptt. årligt). Forbigående – forårsages af højt HCG-niveau i 1. trimester. HCG har TSH-lignende effekt. Ses hyppigt ved hyperemesis gravidarum (dehydratio, 5% vægttab og ketonuri) |
| Graves thyrotoksikose | (Sjælden: Ca 100 ptt. årligt). Skyldes autoimmunitet. TRAb påvises i 95% af tilfældene. Obs TRAb er ofte negativ under graviditet |
| Solitært toksisk adenom Nodøs toksisk struma | (Yderst sjælden) Skyldes nodøs struma, ofte subklinisk thyrotoksikose |
Symptomer og kliniske fund: Link NBV thyrotoksikose
Udredning:
Diagnosen Graves understøttes via påvisning af TRAb, samt ved forekomst af øjensymptomer, struma eller svært forhøjet T3/T4 ratio. Vedvarende thyrotoksikose gennem 2. trimester taler for nodøs toksisk struma.
Diagnosen nodøs toksisk struma understøttes via ultralyds undersøgelse af gld. thyroidea.
Thyroideaskintigrafi udføres principielt ikke under graviditet. Hvis skintigrafi alligevel udføres under graviditet, anses strålerisikoen for minimal, og der er ikke indikation for at tilråde abort (13).
Prognose:
GTT er per definition forbigående. Vedvarende thyrotoksikose gennem 2. trimester taler for anden ætiologi. Graves har tendens til remission under graviditeten med stor risiko for recidiv postpartum. Ved toksisk nodøs struma fortsætter thyrotoksikosen gennem hele graviditeten.
Der er sammenhæng mellem thyrotoksikose og øget abortrisiko, for tidlig fødsel, intrauterin væksthæmning, lav fødselsvægt samt føtal død. Derudover kan overbehandling med antithyroid medicin medføre føtal hypothyroidisme.
Behandlingsmål og kontrolhyppighed under graviditet:
Kvinder med formodet GTT følges klinisk og biokemisk, primært hos obstetriker eller endokrinolog indtil stabilt normalt stofskifte – typisk fra graviditetsuge 13-15.
Behandling:
Gestationel transient thyrotoksikose (GTT):
- Gravide med GTT behandles som udgangspunkt ikke med antithyroid medicin (ATD)
- Kortvarig behandling med betablokker (Propranolol i lavest mulig dosis, eks. 10-20 mg 3-4 gange i døgnet) kan være indiceret ved udtalte thyrotoksiske symptomer.
Graves thyrotoksikose under graviditet (ATD kan seponeres hos op mod 80%)
(Der skelnes mellem let forhøjet stofskifte og moderat/svær thyrotoksikose – klinisk vurdering)
Let forhøjet stofskifte
Nykonstateret thyrotoksikose:
- Observeres uden medicin (forventet stabilisering af autoimmunitet under graviditet) og tæt blodprøve kontrol initialt hver 2. til 4. uge, efterfølgende hver 4. til 6. uge.
Kendt Graves i antithyroid behandling:
- Seponerig af antithyroid behandling overvejes, så snart graviditeten er konstateret.
- Monitoreres stofskiftet tæt hver 2. til 4. uge med henblik på at vurdere behovet for medicinsk behandling.
Moderat til svær thyrotoksikose:
- Anbefales initialt tæt biokemisk kontrol hver 2. til 4. uge, efterfølgende hver 4. til 6. uge. (hvis muligt undgå at give antithyroid medicin i uge 5-10 grundet risiko for medfødte misdannelse).
- Ved behandlingskrævende thyrotoksikose under graviditet gives altid antithyroid medicin i form af monoterapi.
- Ved svær thyrotoksikose opvejer den minimale risiko for evt. malformation ved medicinsk behandling langt konsekvenserne af at undlade at behandle, idet ubehandlet svær thyrotoksikose markant øger risiko for bl.a. abort, for tidlig fødsel og lav fødselsvægt.
- Der gives antithyroid medicin i den lavest mulige dosis, der holder thyroideafunktionen højt i normalområdet. (se afsnit vedr. thyroideafunktionstest)
- Overbehandling skal undgås, og fordi TSH er trægt reagerende skal T4 og T3 altid holdes højt i det trimesterspecifikke referenceinterval; også selvom TSH kan være supprimeret (14).
- Der anbefales behandling med Propylthiuracil (PTU) i første trimester (misdannelses profilen mildere end for Thiamazol) (15 – 20).
- Der anbefales skift fra PTU til thiamazol efter første trimester. I forbindelse med skift af præparat anbefales tæt kontrol af thyroideafunktionen efter 2 til 4 uger. Virkningen af 5 mg thiamazol svarer til virkningen af 100 mg PTU.
- Patienten skal informeres om potentielle alvorlige bivirkninger ved den antithyroide behandling, herunder symptomer og forholdsregler ved eventuel agranulocytose og leversvigt; rutinemæssig måling af leverenzymer ved behandling med PTU anbefales ikke (Link NBV thyrotoksikose)
- Thyroidektomi overvejes ved behandlingssvigt, ved behov for høje doser antithyroid medicin (thiamazol > 30 mg/dag og PTU > 600 mg/dag i en længere periode) eller intolerance over for antithyroid medicin. Total thyroidektomi anbefales udført i andet trimester.
- Behandling med radioaktivjod er kontraindiceret under graviditet
Nodulær toksisk struma
- Behandles som ovenfor anført
Planlægning af graviditet hos patienter med Graves thyrotoksikose:
- Patienter med Graves thyrotoksikose bør anbefales at afvente med graviditet til stofskiftet er normaliseret.
- Hvis patienten vælger at forsøge graviditet under antithyroid medicinsk-behandling, kan det overvejes helt at seponere antithyroid medicinsk behandling så snart graviditeten påvises og efterfølgende monitorere stofskiftet tæt, alternativt anbefales det at omlægge antithyroid medicinsk behandling til PTU i lavest mulige dosis.
Patienten skal samtidigt informeres om mulige medicinske bivirkninger. - Graves patienter i antithyroid medicinsk behandling-behandling skal informeres om straks at henvende sig til behandlende læge, så snart graviditet er konstateret.
- Kvinder og mænd, der har fået radioaktiv jodbehandling, skal informeres om, at der skal gå > 4 måneder efterfølgende før graviditet planlægges. Da TRAb niveauet stiger mange måneder efter radioaktiv jodbehandling og kan persisterende i flere år, tilrådes kontrol af TRAb forud for planlagt graviditet.
Obstetrisk kontrol og føtale aspekter:
- Der anbefales måling af TRAb i 20. til 24. gestationsuge ved Graves thyrotoksikose, ved positiv TRAb tidligere, eller ved tidligere Graves thyrotoksikose behandlet med radioaktivt jod eller thyroidektomi.
- Gravide med Graves thyrotoksikose, herunder kvinder, der tidligere har haft thyrotoksikose, og som nu er eu- eller hypothyroide som følge af medicinsk, kirurgisk eller radiojod behandling, har øget risiko for føtal væksthæmning og tilbydes obstetrisk kontrol med vægtskanning i uge 28 og 32.
- Dysregulerede gravide bør følges med obstetrisk kontrol fra uge 25 hver 4-6 uge. Ved forhøjede TRAb (> 4) suppleres med skanning for føtal struma af føtalmediciner. Barnet bør efter fødslen følges med blodprøver til kontrol af thyroideafunktionen f.eks. i navlesnorsblod, 5, 10 og evt. 15 dage gammelt.
Føtal thyrotoksikose: Kan vise sig i form af: Vækstretardering, takykardi, hydrops eller hjertesvigt. Sjældnere ses ultrasonisk tegn på føtal struma, der dog oftest er tilkommet grundet iatrogent induceret hypothyroidisme ved overbehandling af mødrene med antithyroid medicin (21). Ved tegn på føtal thyrotoksikose eller tvivl om diagnosen skal patienten henvises til en højt specialiseret enhed. Barnet bør efter fødslen følges af pædiater med blodprøver med henblik på kontrol af thyroidea funktionen.
Amning: Brug af methimazol (op til 20-30 mg/dag) samt brug af PTU (op til 300 mg/dag) vurderes at være sikkert under amning (22). Men kontrol af barnets thyroideafunktion 4 og 12 uger efter behandlingsstart anbefales ved brug af methimazol > 15 mg og PTU 300 mg dagligt. Endvidere anbefales det at tage ATD lige efter amning.
Visitation:
Behandling af gravide med thyrotoksikose varetages altid af endokrinolog.
Behandling og vurdering af nyfødte varetages altid af pædiater
Thyroideasygdom og infertilitet
Definitioner
Ved infertilitet forstås udebleven graviditet efter regelmæssig ubeskyttet samleje gennem 1 år.
Forekomst
Infertilitet rammer ca. 15% af alle danske par (34). I en metaanalyse fra 2011 fremgår, at anti-TPO positivitet forekommer hos 6-20% af raske kvinder i fertil alder, og for 10-31% af kvinder med subfertilitet (35).
Thyroidea dysfunktion og autoantistoffer findes hyppigst ved ovariedysfunktion inkl. PCOS samt infertilitet af ukendt årsag (36).
Ætiologi
Ved infertilitet skelnes mellem årsager hos kvinden (35%), hos manden (30%), hos både mand og kvinde (20%) og ukendt årsag (15%). Kvinder med thyroideadysfunktion og/eller isoleret forhøjet anti-TPO har nedsat fertilitet (35). Både ved hypothyroidisme og thyrotoksikose er øget forekomst af menstruationsforstyrrelser velbeskrevet (37-40). Ved korrektion af thyroideadysfunktionen retter disse sig ofte, hvormed udfald af fertilitetsbehandling er sammenlignelig med thyroidea raske personer (41).
Fertilitetsbehandling (kontrolleret ovariestimulation) såvel som graviditet, medfører øgede krav til produktion af stofskiftehormoner, hvilket en normal skjoldbruskkirtel honorerer. Ved forhøjet anti-TPO og/eller subklinisk hypothyroidisme er der risiko for insufficient respons på belastningen og udvikling af hypothyroidisme (13).
Prognose
En metaanalyse fra 2018 af >14000 kvinder i fertilitetsbehandling fandt, at prægestationelt TSH > 3,5-5,0 var associeret med øget risiko for graviditetstab (42).
Der er begrænset evidens for en gavnlig effekt af LT4-substitution hos kvinder med subklinisk hypothyroidisme i fertilitetsbehandling. En metaanalyse af prospektive randomiserede kontrollerede studier af T4-behandling ved subklinisk hypothyroidisme hos kvinder i IVF-behandling viste, at euthyroidisme opnået før ovulationsinduktion øgede chancen for levende fødsel (RR 2,76, 95 % CI: 1,2-6,4) (43).
Interventionsstudier tyder på effekt af LT4 tilskud ved TSH > 4,2 forud for IVF/ICSI og ovariestimulation uanset tilstedeværelse af thyroidea antistoffer (44,45).
Hos euthyroide anti-TPO positive kvinder med infertilitet er der ikke evidens for bedre fertilitetsudfald ved LT4 tilskud (46,47).
Diagnose og udredning
Alle kvinder henvist til fertilitetsbehandling bør screenes for thyroideadysfunktion med måling af TSH og anti-TPO inden opstart af fertilitetsbehandling (se flowchart nedenfor).
Screening for stofskiftesygdom forud for fertilitetsbehandling og anbefalede reaktioner herpå for infertile kvinder uden forudgående kendt stofskiftesygdom
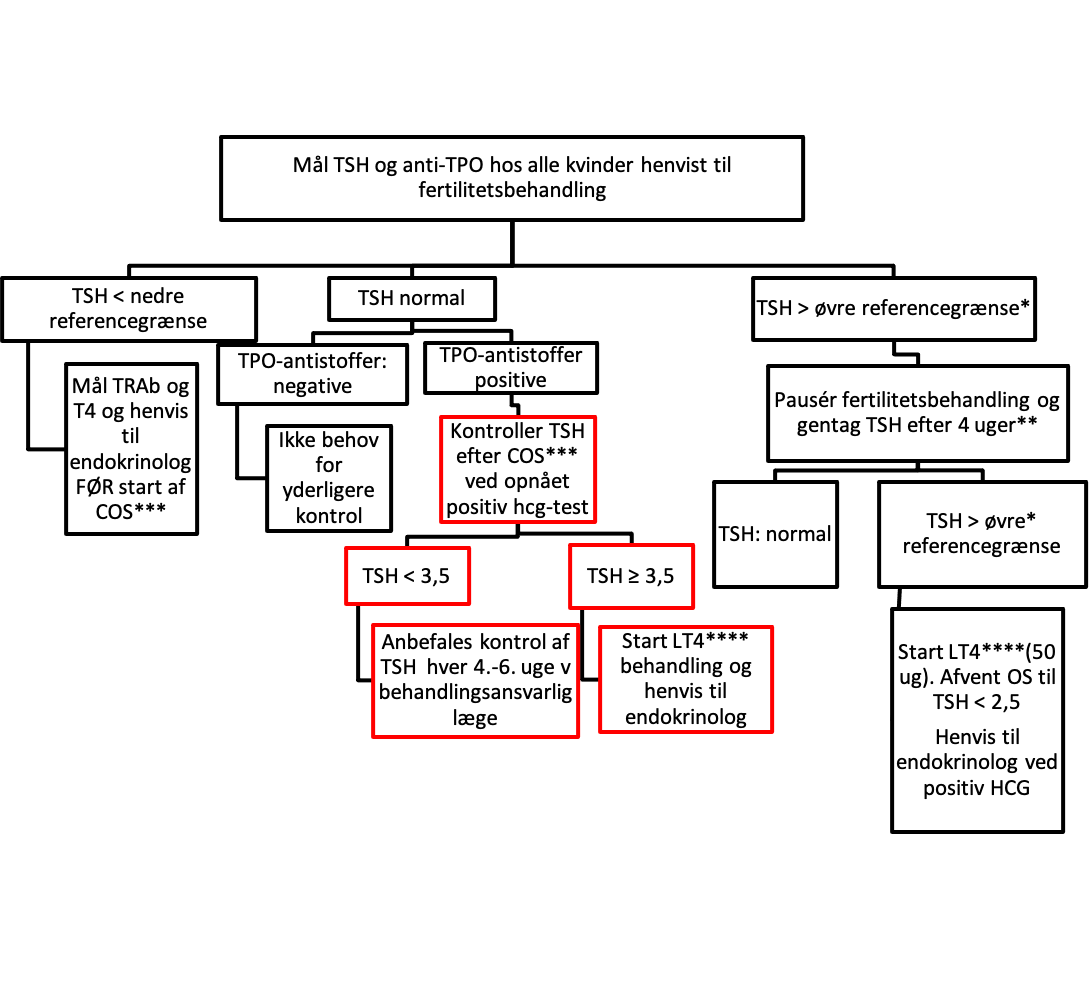
*Øvre laboratoriespecifikke referencegrænse hos ikke-gravide
** Det anbefales at afvente 4 uger før stofskiftetal gentages
*** COS kontrolleret ovariestimulation
****LT4: levothyroxin
Rød tekstkontur = gravid
Sort tekstkontur = ikke-gravid
Kliniske rekommandationer
- Ved TSH < nedre referencegrænse måles TRAb, T3 og T4, og der henvises til endokrinolog før fertilitetsbehandling begyndes. Fertilitetsbehandling bør udsættes, indtil thyroideafunktionen er stabil og normaliseret.
- Anti-TPO-negative kvinder med normalt TSH kræver ikke yderligere kontrol.
- Anti-TPO-positive euthyroide kvinder bør have TSH kontrolleret umiddelbart efter positiv HCG opnået efter OS. Ved TSH < 3.5 mIU/L bør TSH kontrolleres hos behandlingsansvarlig læge hver 4.-6. uge under graviditeten. Ved TSH ≥ 3.5 mIU/L startes LT4 og der henvises til endokrinolog. jf. Link til hypothyreose.
- Ikke gravide kvinder med TSH > øvre laboratoriespecifikke referencegrænse og < 6 pauserer fertilitetsbehandlingen og TSH-måling gentages efter 4 uger. Ved fortsat TSH > øvre laboratoriespecifikke referencegrænse hos ikke-gravide startes LT4 behandling (fx 50 ug LT4/dag). Der stiles mod TSH < 2,5 før ovariestimulationsbehandling begyndes. Behandlingen kan begyndes i fertilitetsregi og efterfølgende varetages af behandlingsansvarlige læge.
Hvis TSH i forbindelse med gentagelse efter 4 uger er indenfor referencegrænserne startes fertilitetsbehandling og TSH kontrolleres når graviditeten er påvist, såfremt TSH ved denne måling er ≥ 3,5 startes LT4 behandling og pt. henvises til endokrinolog. - Kvinder med TSH > 6 sættes straks i behandling med LT4 (fx 50 ug/dag) og der stiles mod TSH < 2,5 før ovariestimulationsbehandling begyndes. Behandlingen kan begyndes i fertilitetsregi og efterfølgende varetages af behandlingsansvarlige læge.
Behandling
- Infertile i behandling med LT4 før opstart af ovariestimulation øges i dosis forud for ovariestimulation til TSH < 2.5 mIU/L. Overbehandling (TSH < nedre referencegrænse) bør undgås.
- Infertile med kendt eller nydiagnosticeret hyperthyrose bør afvente med fertilitetsbehandling, til TSH er normaliseret. Behandling varetages af endokrinolog.
- Infertile med nydiagnosticeret TSH > øvre referencegrænse på to målinger forud for fertilitetsbehandlingen (eller hvis TSH > 6 på første måling) sættes i substitutionsbehandling med LT4. Behandlingsmål er TSH < 2.5 hos ikke-gravide.
- Infertile, der er euthyroide, men med påvist anti-TPO sættes som udgangspunkt ikke i LT4 behandling, men bør få kontrolleret TSH ved opnået graviditet. Hvis TSH ≥ 3.5 startes LT4 behandling og pt. henvises til endokrinolog.
Thyroideasygdom og abortus habitualis
Alle kvinder med abortus habitualis (defineret ved tre eller flere konsekutive graviditetstab (fra positiv test og frem til GA 22+0) bør screenes for anti-TPO og TSH. Behandling af hypothyroidisme kan varetages af vanlig læge hos ikke gravide. Gravide henvises til endokrinolog.
Kvinder med abortus habitualis, som også er i fertilitetsbehandling skal følge anbefalingerne for udredning og behandling af infertile kvinder beskrevet ovenfor.
Definitioner
Abortus habitualis betegner tre eller flere konsekutive graviditetstab (fra positiv test og frem til GA 22+0).
Forekomst
Abortus habitualis forekommer hos ca. 2% af kvinder (38). I en metaanalyse fra 2011 fremgår, at anti-TPO positivitet forekommer hos 6-20% af raske kvinder i fertil alder, og 17-33% af kvinder med abortus habitualis (39).
Ætiologi
Abortus habitualis har multiple årsager, herunder kromosomale, anatomiske, koagulative, endokrine og immunologiske, og i mindst halvdelen af tilfældene findes ingen årsag til graviditetstabene. Ved forekomst af anti-TPO er fundet øget risiko for graviditetstab (48,49), men årsagen er uklar.
Prognose
Hos euthyroide anti-TPO positive kvinder med abortus habitualis er der ikke evidens for en øget chance for levende fødsel ved LT4 tilskud (47,50).
Der er begrænset evidens for en gavnlig effekt af LT4-substitution hos kvinder med subklinisk hypothyroidisme og abortus habitualis. I et dansk observationelt studie (51) havde kvinder med abortus habitualis uden kendt årsag og anti-TPO en øget chance for levende fødsel ved LT4-behandling.
Kliniske rekommandationer
- Alle kvinder med abortus habitualis bør screenes for anti-TPO og TSH.
- Ved TSH < nedre referencegrænse måles TRAb, T3 og T4, og der henvises til endokrinolog. Graviditetsforsøg bør udsættes indtil stofskiftet er stabilt og normaliseret. Link til Graves vedr. planlægning af graviditet.
- Kvinder med abortus habitualis med nydiagnosticeret TSH > øvre referencegrænse på to målinger forud for fertilitetsbehandlingen (eller hvis TSH > 7 på første måling) sættes i substitutionsbehandling med LT4. Behandlingsmål er TSH < 2.5 hos ikke-gravide.
- Kvinder med abortus habitualis, der er euthyroide, men med påvist anti-TPO sættes som udgangspunkt ikke i LT4 behandling, men bør få kontrolleret TSH ved opnået graviditet. Hvis TSH > 3.5 startes LT4 behandling og pt. henvises til endokrinolog.
- Anti-TPO negative kvinder med normalt TSH kræver ikke yderligere kontrol.
- Anti-TPO positive kvinder med normalt TSH er i risiko for at udvikle høj TSH i forbindelse med graviditet, og TSH bør kontrolleres ved opnået graviditet. Ved TSH ≥3.5 mIU/L opstartes LT4, og der henvises til endokrinolog. Ved TSH < 3.5 bør TSH kontrolleres hos egen læge hver 4.-6. uge under graviditeten jf. Link til hypothyreose.
Behandling
- Kvinder med abortus habitualis i fertilitetsbehandling skal følge anbefalingerne for udredning og behandling af infertile kvinder Link til infertilitet.
- Kvinder med abortus habitualis i behandling med LT4 øges i dosis ved planlægning af graviditet mhp. TSH < 2.5. Ved positiv HCG stiles imod TSH < 3,5 og henvises til endokrinolog. Overbehandling (TSH < nedre referencegrænse) bør undgås. Link til hypothyroidisme.
- Kvinder med abortus habitualis med kendt eller nydiagnosticeret hyperthyreose bør afvente graviditet, indtil TSH og T4 er normaliseret. Behandling varetages af endokrinolog.
- Kvinder med abortus habitualis og nydiagnosticeret TSH > øvre referencegrænse på to målinger (eller hvis TSH > 6 på første måling) sættes i substitutionsbehandling med LT4. Behandlingsmål er TSH < 2.5 hos ikke-gravide.
- Kvinder med abortus habitualis, der er euthyroide, men med påvist anti-TPO sættes som udgangspunkt ikke i LT4 behandling, men bør få kontrolleret TSH ved opnået graviditet. Hvis TSH ≥ 3.5 startes LT4 behandling og pt. henvises til endokrinolog.
Visitation
Fertilitetsbehandlede/abortus habitualis med hyperthyroidisme henvises til endokrinolog
Fertilitetsbehandlede/abortus habitualis med manifest hypothyroidisme/subklinisk hypothyroidisme henvises til læge – når graviditet påvises viderehenvises til endokrinolog.
Fertilitetsbehandlede/abortus habitualis, der er euthyroide, men med påviste anti-TPO henvises til læge– når graviditet påvises måles TSH og ved behandlingsbehov viderehenvises til endokrinolog.
Referencer
1. 2017 Guidelines of the American Thyroid Association for the Diagnosis and Management of Thyroid Disease During Pregnancy and the Postpartum Erik K. Alexander, Elisabeth N. Pearce, Gregory A. Brent, Rosalind S. brown, Herbert Chen, Chrysoula Dosiou, William A Grobman, Laurberg, John H. Lazarus, Susan J. Mandel, Robin P Peeters, and Scott Sullivan. Thyroid 2017 3 315-388. http://doi.org/10.1089/thy.2016.0457
2. Bliddal S, Feldt-Rasmussen U, Boas M, Faber J, Juul A, Larsen T & Precht DH. Gestational age-specific reference ranges from different laboratories misclassify pregnant women’s thyroid status: comparison of two longitudinal prospective cohort studies. Eur J Endocrinol 2014 170 329-339.
3. Knøsgaard L, Andersen S, Bo Hansen A, Vestergaard P, Andersen SL. Thyroid function abnormalities and thyroid autoantibodies in Danish pregnant women. Clinical Endocrinology. 2019 dec 25. https://doi.org/10.1111/cen.14147
4. Bliddal S, Boas M, Hilsted L, Friis-Hansen L, Tabor A & Feldt-Rasmussen U. Thyroid function and autoimmunity in Danish pregnant women after an iodine fortification program and associations with obstetric outcomes. Eur J Endocrinol 2015 173 (6) 709-718.
5. Carle A, Laurberg P, Pedersen IB, Knudsen N, Perrild H, Ovesen L, Rasmussen LB & Jorgensen T. Epidemiology of subtypes of hypothyroidism in Denmark. Eur J Endocrinol 2006 154 21-28.
6. Pedersen IB, Knudsen N, Jorgensen T, Perrild H, Ovesen L & Laurberg P. Thyroid peroxidase and thyroglobulin autoantibodies in a large survey of populations with mild and moderate iodine deficiency. Clin Endocrinol 2003 58 36-42.
7. Clinical Strategies in the Testing of Thyroid Function. Feldt-Rasmussen U, Klose M.2020 Nov 20. In: Feingold KR, Anawalt B, Boyce A, Chrousos G, de Herder WW, Dhatariya K et al. Endotext [Internet]. South Dartmouth (MA): MDText.com, Inc.; 2000 PMID: 25905413
8. Carle A, Pedersen IB, Knudsen N, Perrild H, Ovesen L & Laurberg P. Hypothyroid symptoms and the likelihood of overt thyroid failure: a population-based case-control study. Eur J Endocrinol 2014 171 593-602.
9. Carle A, Bulow P, I, Knudsen N, Perrild H, Ovesen L & Laurberg P. Gender differences in symptoms of hypothyroidism: a population-based DanThyr study. Clin Endocrinol (Oxf) 2015
10. Knøsgaard L, Andersen S, Hansen AB, Vestergaard P, Andersen SL. Classification of maternal thyroid function in early pregnancy using repeated blood samples. Eur Thyroid J. 2022 Feb 2;11(2)
11. Maraka S, Mwangi R, McCoy RG et al. Thyroid hormone treatment among pregnant women with subclinical hypothyroidism: US national assessment. BMJ. 2017 Jan 25;356:i6865.
12. Absence of placental Transfer of L-triiodthyronine (T3) in Rat (1977).
https://www.nature.com/pr/journal/v11/n2/pdf/
13. Sima Nazarpour, Fahimeh Ramezani Tehrani, Masoumeh Simbar: Effects of Levothyroxine on Pregnant Women With Subclinical Hypothyroidism, Negative for Thyroid Peroxidase Antibodies The Journal of Clinical Endocrinology & Metabolism, Volume 103, Issue 3, March 2018, Pages 926–935.
14. Pregnance and radiation protection in nuclear medicine. Available at: https://rpop.iaea.org/RPOP/RPoP/Content/SpecialGroups/1_PregnantWomen/PregnancyNuclearMedicine.htm. 2015. Ref Type: Electronic Citation
15. Bliddal S, Rasmussen AK, Sundberg K, et al. Antithyroid drug-induced fetal goitrus hypothyroidism. Nat Rev Endocrinol 2011;(7):396-406.
16. Laurberg P, Wallin G, Tallstedt L, Abraham-Nordling M, Lundell G & Torring O. TSH-receptor autoimmunity in Graves’ disease after therapy with anti-thyroid drugs, surgery, or radioiodine: a 5-year prospective randomized study. Eur J Endocrinol 2008 158 69-75
17. Glinoer D.The regulation of thyroid function in pregnancy: pathways of endocrine adaptation from physiology to pathology. Endocr Rev. 1997;18(3):404.
18. Cassina M, Dona M, Di Gianantonio E & Clementi M. Pharmacologic treatment of hyperthyroidism during pregnancy. Birth Defects Res A Clin Mol Teratol 2012 94 612-619.
19. Bowman P, Osborne NJ, Sturley R & Vaidya B. Carbimazole embryopathy: implications for the choice of antithyroid drugs in pregnancy. QJM 2012 105 189-193.
20. Taylor PN, Vaidya B. Side effects of anti-thyroid drugs and their impact on the choice of treatment for thyrotoxicosis in pregnancy. Eur Thyroid J 2012 1 176-185
21. Andersen SL, Olsen J, Wu CS & Laurberg P. Birth defects after early pregnancy use of antithyroid drugs: a Danish nationwide study. J Clin Endocrinol Metab 2013 98 4373-4381.
22. Bliddal S, Rasmussen AK, Sundberg K, Brocks V & Feldt-Rasmussen U. Antithyroid drug-induced fetal goitrous hypothyroidism. Nat Rev Endocrinol 2011 7 396-406.
23. Kahaly GJ, Bartalena L, Hegedüs L, Leenhardt L, Poppe K, Pearce SH. 2018 European Thyroid Association Guideline for the Management of Graves’ Hyperthyroidism. Eur Thyroid J. 2018;7(4):167-186. doi:10.1159/000490384
24. Feldt-Rasmussen U, Bliddal Mortensen AS, Rasmussen AK, Boas M, Hilsted L & Main K. Challenges in interpretation of thyroid function tests in pregnant women with autoimmune thyroid disease. J Thyroid Res 2011 2011 598712.
25. Glinoer D. Tjr Regulation of Thyroid function in pregnancy: pathways of endocrine adaption from physiology to pathology. Endocr Rev 1997;18(3):404-33.
26. Bliddal S, Boas M, Hilsted L, et al. Increase in thyroglobulin antibody and thyroid peroxidase antibody levels, but not preterm birth-rate in pregnant Danish women upon iodine fortification. Eur J Endocrinol 2017;176(5):603-12
27. Baloch Z, Carayon P, Conte-Devolx B, Demers LM, Feldt-Rasmussen U, Henry JF, LiVosli VA, Niccoli-Sire P, John R, Ruf J, Smyth PP, Spencer CA & Stockigt JR. Laboratory medicine practice guidelines. Laboratory support for the diagnosis and monitoring of thyroid disease. Thyroid 2003 13 3-126
28. Boas M, Forman JL, Juul A, Feldt-Rasmussen U, Skakkebaek NE, Hilsted L, Chellakooty M, Larsen T, Larsen JF, Petersen JH & Main KM. Narrow intra-individual variation of maternal thyroid function in pregnancy based on a longitudinal study on 132 women. Eur J Endocrinol 2009 161 903-910.
29. Laurberg P, Andersen SL, Hindersson P, et al. Dynamics and Predictors of Serum TSH and fT4 Reference limits in Early Pregnancy: A Study Within the Danish National Birth Cohort. J Clin Endocrinolmetab 2016;101(6):2484-92.
30. Bliddal S,Feldt-Rasmussen U, Boas M et al Gestational age-specifik reference ranges from different laboratories misclassify pregnant women’s thyroid status:comparison of two longitudinal prospective cohort studies. Eur J Endocrinol 2014; 170(2):329-39.
31. Andersen SL, Andersen S, Carlé A, Christensen PA, Handberg A, Karmisholt J, Knøsgaard L, Kristensen SR, Bülow Pedersen I, Vestergaard P. Pregnancy Week-Specific Reference Ranges for Thyrotropin and Free Thyroxine in the North Denmark Region Pregnancy Cohort. Thyroid. 2019 Mar;29(3):430-438. doi: 10.1089/thy.2018.0628. Epub 2019 Feb 27. PMID: 30734656.
32. Andersen SL, Christensen PA, Knøsgaard L, Andersen S, Handberg A, Hansen AB, Vestergaard P. Classification of Thyroid Dysfunction in Pregnant Women Differs by Analytical Method and Type of Thyroid Function Test. J Clin Endocrinol Metab. 2020 Nov 1;105(11):dgaa567. doi: 10.1210/clinem/dgaa567. PMID:32835377
34. Van den Boogaard E, Vissenberg R, Land JA, et al. Significance of (sub)clinical thyroid dysfunction and thyroid autoimmunity before conception and in early pregnancy: a systematic review. Hum Reprod Update 2011;17(5):605-19
35. Larsen EC, Christiansen OB, Kolte AM, et al. New insights into mechanisms behind miscarriage. BMC Med 2013;11:154
36. Vissenberg R, Fliers E, van der Post JA, et al. Live-birth rate in euthyroid women with recurrent miscarriage and thyroid peroxidase antibodies. Gynecol Endocrinol 2015:1-4.
37. Krassas GE, Poppe K, Glinoer D. Thyroid function and human reproductive health. Endocr Rev 2010;31(5):702-55
38. Krassas GE, Pontikides N, Kaltsas T, et al. Menstrual disturbances in thyrotoxicosis. Clin Endocrinol (Oxf) 1994;40(5):641-44
39. Krassas GE, Pontikides N, Kaltsas T, et al. Disturbances of menstruation in hypothyroidism. Clin Endocrinol (Oxf) 1999;50(5):655-59.
40. Honbo KS, Van Herle AJ, Kellett KA. Serum prolactin levels in untreated primary hypothyroidism. AmJMed 1978;64(5):782-87.
41. Busnelli A, Somigliana E, Benaglia L, et al. In vitro fertilization outcomes in treated hypothyroidism. Thyroid 2013;23(10):1319-25
42. Zhao J, Huang X, Xu B et al. Whether vitamin D was associated with clinical outcome after IVF/ICSI: a systematic review and meta-analysis. Reprod Biol Endocrinol. 2018 Feb 9;16(1):13.
43. Velkeniers B, Van MA, Poppe K, et al. Levothyroxine treatment and pregnancy outcome in women with subclinical hypothyroidism undergoing assisted reproduction technologies: systematic review and meta-analysis of RCTs. Hum Reprod Update 2013;19(3):251-58
44. Abdel Rahman AH, Aly Abbassy H, Abbassy AA. Improved in vitro fertilization outcomes after treatment of subclinical hypothyroidism in infertile women. Endocr Pract. 2010 Sep-Oct;16(5):792-7.
45. Kim CH, Ahn JW, Kang SP et al. Effect of levothyroxine treatment on in vitro fertilization and pregnancy outcome in infertile women with subclinical hypothyroidism undergoing in vitro fertilization/intracytoplasmic sperm injection. Fertil Steril. 2011 Apr;95(5):1650-4.
46. Wang H, Gao H, Chi H, et al. Effect of Levothyroxine on Miscarriage Among Women With Normal Thyroid Function and Thyroid Autoimmunity Undergoing In Vitro Fertilization and Embryo Transfer: A Randomized Clinical Trial. JAMA 2017;318(22):2190-98.
47. Dhillon-Smith RK, Middleton LJ, Sunner KK et al. Levothyroxine in Women with Thyroid Peroxidase Antibodies before Conception. N Engl J Med. 2019 Apr 4;380(14):1316-1325. doi: 10.
48. Seungdamrong A, Steiner AZ, Gracia CR, et al. Preconceptional antithyroid peroxidase antibodies, but not thyroid-stimulating hormone, are associated with decreased live birth rates in infertile women. Fertil Steril 2017
49. Busnelli A, Paffoni A, Fedele L, et al. The impact of thyroid autoimmunity on IVF/ICSI outcome: a systematic review and meta-analysis. Hum Reprod Update 2016
50. van Dijk MM, Vissenberg R, Fliers E et al. Levothyroxine in euthyroid thyroid peroxidase antibody positive women with recurrent pregnancy loss (T4LIFE trial): a multicentre, randomised, double-blind, placebo-controlled, phase 3 trial. Lancet Diabetes Endocrinol. 2022 May;10(5):322-329. doi: 10.
51. Bliddal S, Feldt-Rasmussen U, Rasmussen ÅK et al Thyroid Peroxidase Antibodies and Prospective Live Birth Rate: A Cohort Study of Women with Recurrent Pregnancy Loss. Thyroid. 2019 Oct;29(10):1465-1474. doi: 10.
Tovholder
Øvrige forfattere
Julie Pildal
Inge Bülow Pedersen
Henriette Svarre Nielsen
Ulla Feldt-Rasmussen
Trine Nielsen
Birte Nygård
Anne Benedicte Juul
Malene Boas
Sofie Bliddal
Thomas Brix
Seneste revision: Oktober 2022
Næste revision: Februar 2025
