Hvad omfatter denne NBV
Hypothyroidisme eller thyrotoksikose opstået under eller senest 1½ efter behandling med amiodaron (Cordarone, Cordan, Amiodarone, Amiodaronhydrochlorid), hvor anden subtype-klassifikation1;2 kan udelukkes.
Hvad omfatter denne NBV ikke:
Thyroidea-dysfunktion forårsaget af andre medikamenter så som lithium, interferon-α, interleukin-2, tyrosin kinase inhibitorer (se under NBV omhandlende thyroidit).
Diagnosekoder (ICD)
E03.2 Hypothyroidisme forårsaget af lægemiddel
E03.9 Hypothyroidisme
E05.8 Anden form for thyrotoksikose
E05.9 Thyrotoksikose
Forkortelser
AIH – amiodaron-induceret hypothyroidisme
AIT – amiodaron-induceret thyrotoksikose
Inddeling og beskrivelse
Det er vigtigt at skelne mellem de fysiologiske forandringer i thyroidea hormon niveauer som altid følger opstart af amiodaron-behandling og udvikling af amiodaron-induceret thyroidea sygdom.
- De fysiologiske forandringer følger umiddelbart efter start af amiodaron-behandlingen og gennemgår ofte forskellige faser (figur 1), hvorimod udviklingen af amiodaron-induceret thyroidea sygdom oftest forekommer senere (dog stor variation). Differentieringen mellem de fysiologiske forandringer og amiodaron-induceret thyroidea sygdom kan være en udfordring (figur 2).
- Amiodaron-induceret thyroidea sygdom opdeles i amiodaron-induceret hypothyroidisme (AIH) med højt TSH og lavt T4, samt amiodaron-induceret thyrotoksikose (AIT) med lavt TSH samt højt T3 og /eller T4. Ifølge Trohman 3 har 80% af alle AIT normalt T3, men det er jo betinget af den præcise definition. Thyrotoksikose, uanset om denne er subklinisk eller overt, er behæftet med risiko for hjertearytmi og hjertesvigt og skal således behandles.
- AIT underopdeles i:
- AIT type I med thyrotoksikose betinget af øget thyroidea-hormon produktion
- AIT type II med thyrotoksikose forårsaget af udsivning af præformerede thyroidea-hormoner fra en inflammatorisk thyroidea-kirtel
- En blandingsform ´mixed´-type kan forekomme
- AIT underopdeles i:
De forskellige typer AIT adskiller sig fra hinanden på adskillige punkter (se tabel 1).
Ved amiodaron-opstart (0-3 måneder) ses stigning i TSH, samt grundet hæmning af perifere dejodinaser også øget T4 og lavere T3. Senere (>3 måneder) normaliseres TSH, mens T4 fortsat ligger lidt høj (evt. blot højt normalt) og T3 ligger lidt lavt (evt. blot lavt normalt). Dette skal skelnes fra AIH hvor TSH er høj og T4 lav. Ligeledes skelnes det fra AIT, hvor TSH er lav, mens T3 og/eller T4 er høj.
Figur 1: De forskellige fysiologiske forandringer over tid efter opstart af amiodaron-behandling (reference-grænser for det euthyroide spektrum er markeret stiplet linie).
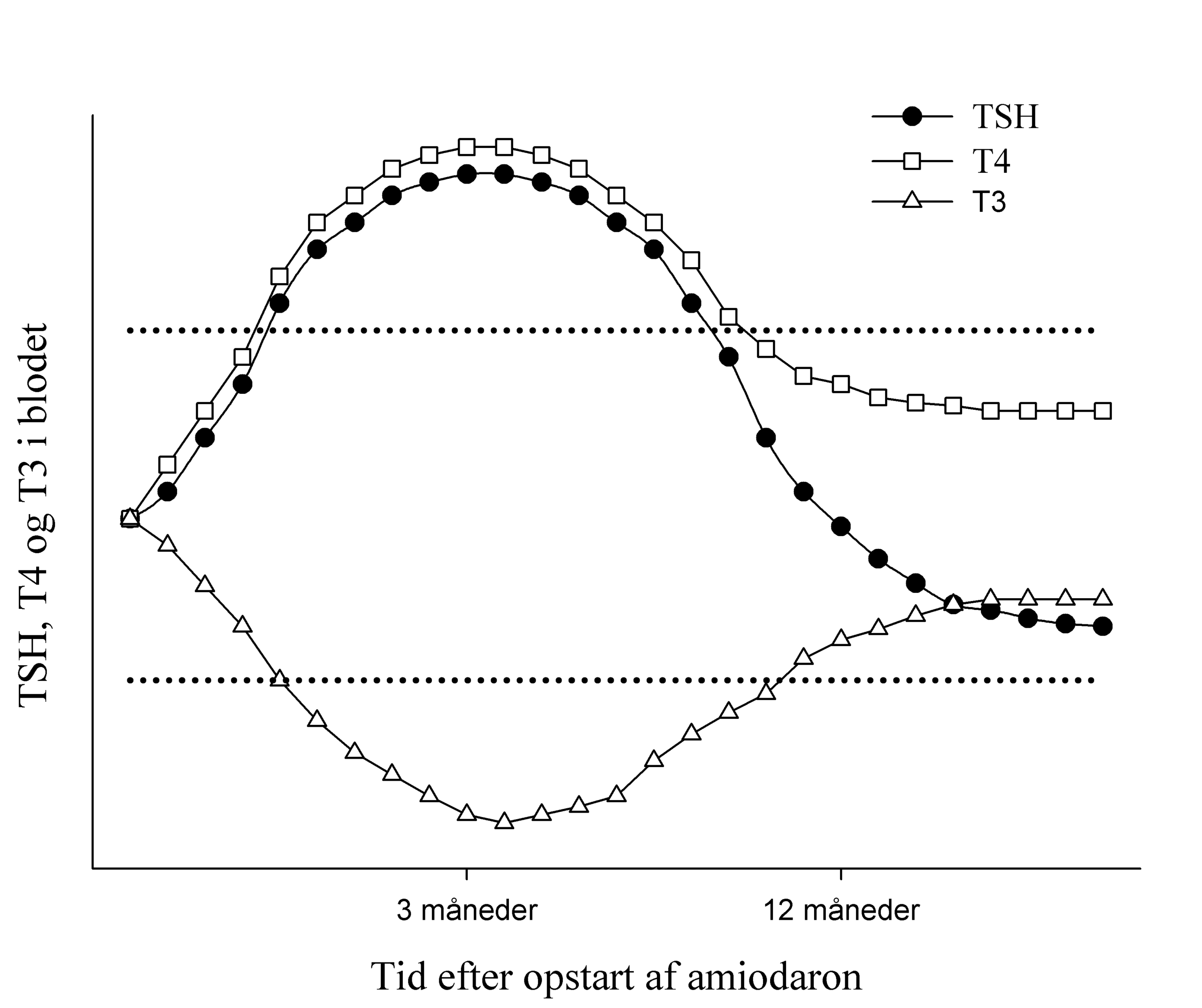
Amiodaron-betinget thyroidea-sygdom kan udvikles selv meget sent, da amiodaron er meget lipofilt og således ophobes i fedtvæv. Såvel amiodaron og dets aktive metabolit desthylamiodaron (DEA) har lange halveringstider på omkring 40 og 57 dage, og er målt i serum selv op til 10 måneder efter seponering 4. Selv lang tid efter amiodaron-seponering er der risiko for udvikling af thyroidea-sygdom. Omkring 5% af AIT type I og 23% af AIT type II ses efter at amiodaron er seponeret 5. Således foreslås det, at stofskiftet kontrolleres hver ½ år efter amiodaron-seponering (AIT type I: indtil 1 år efter, AIT type II: indtil 1½ år efter).
T3 har ingen plads i diagnosticering af AIH 6 (her kræves høj TSH og lav T4 som ved alle typer hypothyroidisme).
Epidemiologi
Livstidsrisikoen for udvikling af biokemisk stofskiftesygdom er i udenlandske reviews opgjort til ca. 15% 6. I perioden før den danske jodberigelse af salt var incidensraterne af AIH 1 og AIT 2 på henholdsvis 1.30 og 0.72 per 100.000 person-år svarende til ca. 2 % af alle tilfælde med stofskiftesygdom i Danmark. I fremtiden må vi i Danmark forvente en stigning af AIH og et fald i AIT grundet stigende jodindtag.
Risikofaktorer
Amiodaron-induceret hypothyroidisme (AIH): kvindeligt køn, høj alder, højt TSH 7 samt TPOAb+ 6 forud for behandlingsstart er forbundet med øget risiko for AIH.
Amiodaron-induceret thyrotoksikose (AIT) type I: jodmangel og præeksisterende thyroideasygdom i form knuder og evt. positiv TRAb disponerer til udvikling af AIT type I.
Amiodaron-induceret thyrotoksikose (AIT) type II: udvikles mere tilfældigt hos patienter uden forudgående patologi i gl. thyroidea og blodprøver. Kun jodmangel disponerer til AIT type II
Symptomer og kliniske fund
Amiodaron-induceret hypothyroidisme (AIH): symptombilledet ved hypothyroidisme ligner det ved autoimmun Hashimoto´s myxødem 6, som er præget af uspecifikke klager hos de yngre og ofte fraværende symptomer hos de ældre 8. Dog synes der evidens for at svær ubehandlet AIH kan disponere til udvikling af fatale arytmier 6.
Amiodaron-induceret thyrotoksikose (AIT): symptomerne ved såvel type 1, type 2 og blandingstilstanden er som ved andre typer thyrotoksikose, dog vil både tremor og takykardi ofte være fraværende jvf. amiodarons anti-adrenerge effekt 9.
Udredning
Før opstart af amiodaron anbefales måling af TSH + T4-estimat + TPOAb (risikofaktor for AIH) + TRAb (risikofaktor for AIT type II) anbefales.
Amiodaron-induceret hypothyroidisme (AIH): ingen specifik udredning.
Amiodaron-induceret thyrotoksikose (AIT) type I: er kendetegnet ved bagvedliggende (latent) thyroidea-sygdom som Graves´ sygdom eller (a)toksisk nodulær struma 6;10, hvilket således vil vise sig ved positiv TRAb-måling og/eller knuder set ved ultralydsundersøgelse (figur 2). Sygdomsmekanismen er øget produktion af stofskiftehormon grundet den såkaldte Jod-Basedow effekt. Da amiodaron indeholder store mængder jod (200 mg amiodaron indeholder 37.5 mg jod hvoraf 10% optages over tarmvæggen sv.t. 50 x den anbefalede daglige dosis), vil der ofte være nedsat Tc-optagelse på scintigrammet, hvorfor dette ikke kan skelne AIT type I fra type II.
Amiodaron-induceret thyrotoksikose (AIT) type II: denne er hyppigere end AIT type I. Der er som ved andre thyroiditis-tilstande tale om en destruktiv proces med en frigivelse af præformeret stofskiftehormon 6;10.
´Mixed´ AIT: denne entitet er meget omdiskuteret, både hvad angår hyppighed, men især også hvad angår behandling (se denne).
Differentiering mellem AIT type 1 og 2: Ultralyd med Doppler-flow visualisering anses som den bedste undersøgelse til differentiering mellem type I med øget flow (øget produktion) og type II (ingen flow, thyroiditis) 6;11 jf. tabel 1.
Tabel 1. Amiodaron-induceret thyrotoksikose (AIT)
| AIT – type I | AIT – type II | |
| Hyppighed Præeksisterende thyroidasygdom | Mindre hyppigt Ja | Hyppigst Nej |
| Patogenese | Jodinduceret thyreotoxikose | Destruktiv thyroiditis |
| TSH-receptorantistoffer | Evt. TRAb+ ved AIT type 1 | Nej |
| Radiojodoptagelse v. 99mTc-skintigrafi | (Normal til) lav | Manglende eller lav |
| Ultralyd, struktur | Diffus eller nodulær struma | Vekslende ekkogenesitet |
| Ultralyd, Doppler-flow | Normal til øget flow | (Nedsat eller) ingen flow |
| Spontan remission | Usandsynligt | Sandsynligt |
| Fortsætte amiodaron | Nej | Ja |
| Behandlingsvalg | Thionamider (højdosis) | Prednisolon |
Behandling
Amiodaron-induceret hypothyroidisme (AIH): Ophør af amiodaron medfører ofte spontan normalisering af stofskiftet indenfor 2-4 måneder, men seponering er dog sjældent mulig 6. Amiodaron-behandlingen kan fortsætte under L-T4 substitution 10. Da patienterne ofte er ældre og har hjertesygdom er det vigtigt at man ikke overbehandler. Man bør sigte efter normalisering af T4 og TSH i øvre tredjedel af normalområdet 6;10, evt. acceptere TSH op imod 10 mU/l. Anbefalet startdosis er 25-50 µg/dag, kontrol af stofskiftet hver 4-6 uge, med optitrering til TSH mål er nået.
Subklinisk AIH bør sjældent behandles, da evt. overbehandling medfører specielt høj risiko for kardiovaskulære events hos denne patientgruppe 12.
Amiodaron-induceret thyrotoksikose (AIT) type I: Skyldes overproduktion af stofskiftehormon som oftest er udløst eller forværret af det rigelige jod-indtag. Førstevalget er derfor thiamazol (Thycapzol, Thiamazol, Unimazole) eller PTU i ækvipotente doser, som på grund af jodkontaminering ofte må gives i meget høje doser (op imod 40-60 mg Thiamazol dgl. 6) (figur 2). Neo-Mercazole (carbimazol) er ikke førstevalg, da der er dyrere og mindre effektivt. Ved svær/ behandlings resistent thyrotoxicosis kan PTU med fordel anvendes, idet PTU (modsat thiamazol) har en hæmmende effekt på Deiodinase 2 og dermed sænker T3 niveauet. Da der er tale om en hyperfungerende kirtel, vil det oftest være nødvendigt at seponere det jodholdige substrat amiodaron 4 med mindre de kardiovaskulære konsekvenser er overhængende derved. Derfor er individuel patient vurdering i et samarbejde mellem kardiologer, thyroidea-kirurger, og endokrinologer væsentlig (figur 3). Når stofskiftet er normaliseret, bør definitiv behandling (radioaktivt jod (RI) eller thyroidektomi (Tx)) overvejes 6.Tx kan udføres umiddelbart, mens der grundet jodkontaminering ofte bør gå 6-12 måneder inden RI kan gives 6.
Amiodaron-induceret thyrotoksikose (AIT) type II: ved mildere grader af thyrotoksikose og stabil hjertesygdom vil man ofte afvente den spontane remission indenfor få måneder 13. Vælges behandling er førstevalget glukokortokoid (fx Prednisolon ½ mg/kg 14, oftest ca. 37,5 mg (figur 2) – stort set ækvivalent til 30 mg fra udenlandske studier 6 som normaliserer stofskiftet hos stort set alle 6. Det synes sikkert at fortsætte med amiodaron ved denne subtype 6, da tilstedeværelse af højt jodindhold ikke er en patogenetisk faktor. Behandlingen fortsættes indtil patienten er euthyroid, hvilket sker efter 1-3 måneder 14. Derefter kan gradvis nedtrapning ske.

Figur 2: Karakteristika og behandling ved de forskellige typer amiodaron-induceret thyrotoksikose (AIT) (type I, type II og ´mixed type´).
Der henvises til NBV for osteoporose og osteopeni ved længerevarende brug af steroid (se NBV osteoporose ved glucocorticosteroid behandling). Behandlingen fortsættes til patienten er klinisk og biokemisk euthyroid.
AIT og livstruende hjertesygdom (meget sjældne tilfælde): her vil det ofte være påkrævet med umiddelbar definitiv behandling. Thyroidektomi (Tx) er oftest den bedste behandling til at opnå euthyroid tilstand hos svært hjertesyge patienter 6. ´Salvage thyroidectomy´ skal overvejes til patienter med nedsat EF hvor mortaliteten er næsten 50% 6 og til patienter med maligne arytmier 6. Tx kan faktisk udføres selv ved moderat til svært nedsat EF 6. Vælges Tx, vil det oftest være nødvendigt at forudbehandle med store mængder jod (fx KI 200 mg x 1 i 10 dage) 15 før thyroidektomi udføres, med mindre den kardiovaskulære risiko tilsiger øjeblikkelig thyroidektomi. Radioaktivt jod (RI) er ofte uvirksom grundet jodforureningen af amiodaron (type I AIT) eller som en del af det patogenetiske billede (type II AIT) og virkningen indtræder over uger til måneder.
Såfremt definitiv behandling ikke ønskes, er kombinationsbehandling med thionamid og glukokortikoid en mulighed 6.
Hvorvidt subklinisk AIT type I skal behandles, må bero på en vurdering hvor kardiologiske overvejelser skal indgå 6.
´Mixed´ AIT: såfremt der er manglende effekt af primær behandlingen kan denne blandingstype AIT overvejes og behandles med både thionamider og glukokortikoid. Der er ikke evidens for primært at starte dual-behandling af alle med AIT.
Prognose og opfølgning
Efter behandling af Amiodaron-induceret hypothyroidisme (AIH): Da hypothyreosen ofte forsvinder hos TPOAb-negative patienter 6, bør man specielt hos disse forsøge udtrapning af thyroxin efter ca. 6-12 måneders behandling 16. Hos TPOAb-positive patienter er der øget risiko for permanent hypothyroidisme.
Efter behandling af AIT: ved AIT type I er livslang stofskifte-monitorering grundet bagvedliggende patologi ofte nødvendig også selv efter evt. seponering af amiodaron. Efter AIT type II, vil det ofte kun være nødvendig at følge stofskifte så længe patienten behandles med amiodaron.
Reintroduktion af amiodaron efter seponering: såfremt man påbegynder en pauseret/seponeret behandling med amiodaron grundet thyroidea-dysfunktion er den senere risiko for såvel AIH samt AIT begge på ca. 30%.
Referencer:
- Carle A, Laurberg P, Pedersen IB, Knudsen N, Perrild H, Ovesen L et al. Epidemiology of subtypes of hypothyroidism in Denmark. Eur.J.Endocrinol. 2006;154:21-8.
- Carle A, Pedersen IB, Knudsen N, Perrild H, Ovesen L, Rasmussen LB et al. Epidemiology of subtypes of hyperthyroidism in Denmark: a population-based study. Eur.J.Endocrinol. 2011;164:801-9.
- Trohman RG, Sharma PS, McAninch EA, Bianco AC. Amiodarone and thyroid physiology, pathophysiology, diagnosis and management. Trends Cardiovasc.Med 2019;29:285-95.
- Plomp TA, van Rossum JM, Robles de Medina EO, van Lier T, Maes RA. Pharmacokinetics and body distribution of amiodarone in man. Arzneimittelforschung. 1984;34:513-20.
- Tomisti L, Rossi G, Bartalena L, Martino E, Bogazzi F. The onset time of amiodarone-induced thyrotoxicosis (AIT) depends on AIT type. Eur.J.Endocrinol. 2014;171:363-8.
- Bartalena L, Bogazzi F, Chiovato L, Hubalewska-Dydejczyk A, Links TP, Vanderpump M. 2018 European Thyroid Association (ETA) Guidelines for the Management of Amiodarone-Associated Thyroid Dysfunction. Eur.Thyroid J. 2018;7:55-66.
- Albert SG, Alves LE, Rose EP. Thyroid dysfunction during chronic amiodarone therapy. J.Am.Coll.Cardiol. 1987;9:175-83.
- Carle A, Pedersen IB, Knudsen N, Perrild H, Ovesen L, Andersen S et al. Hypothyroid Symptoms Fail to Predict Thyroid Insufficiency in Old People: A Population-Based Case-Control Study. Am.J.Med. 2016;129:1082-92.
- Hartong R, Wiersinga WM, Plomp TA. Amiodarone reduces the effect of T3 on beta adrenergic receptor density in rat heart. Horm.Metab Res. 1990;22:85-9.
- Bogazzi F, Tomisti L, Bartalena L, Aghini-Lombardi F, Martino E. Amiodarone and the thyroid: a 2012 update. J.Endocrinol.Invest 2012;35:340-8.
- Bogazzi F, Bartalena L, Brogioni S, Mazzeo S, Vitti P, Burelli A et al. Color flow Doppler sonography rapidly differentiates type I and type II amiodarone-induced thyrotoxicosis. Thyroid 1997;7:541-5.
- Stott DJ, Rodondi N, Kearney PM, Ford I, Westendorp RG, Mooijaart SP et al. Thyroid Hormone Therapy for Older Adults with Subclinical Hypothyroidism. N.Engl.J.Med. 2017.
- Eskes SA, Endert E, Fliers E, Geskus RB, Dullaart RP, Links TP et al. Treatment of amiodarone-induced thyrotoxicosis type 2: a randomized clinical trial. J.Clin Endocrinol.Metab 2012;97:499-506.
- Bogazzi F, Bartalena L, Martino E. Approach to the patient with amiodarone-induced thyrotoxicosis. J.Clin.Endocrinol.Metab 2010;95:2529-35.
- Bogazzi F, Miccoli P, Berti P, Cosci C, Brogioni S, Aghini-Lombardi F et al. Preparation with iopanoic acid rapidly controls thyrotoxicosis in patients with amiodarone-induced thyrotoxicosis before thyroidectomy. Surgery 2002;132:1114-7.
- Martino E, Aghini-Lombardi F, Mariotti S, Bartalena L, Lenziardi M, Ceccarelli C et al. Amiodarone iodine-induced hypothyroidism: risk factors and follow-up in 28 cases. Clin.Endocrinol.(Oxf) 1987;26:227-37.
Tovholder
Allan Carlé
Oprettet: Oktober 2018
Revideret: Oktober 2021
Næste revision: Oktober 2024
Øvrig arbejdsgruppe:
Birte Nygaard
Lena Bjergved Sigurd
Jesper Karmisholt
Nils Knudsen
Lars Folkestad
Interessekonflikter:
Ingen
