Hvad omfatter denne NBV
- Primær hyperaldosteronisme (PHA) DE26.0, der omfatter følgende subtyper
- Aldosteron producerende adenomer DE26.0
- Aldosteron producerende adrenocorticale carcinomer DC74.0 & DE26.9
- Bilateral adrenal hyperplasi DE26.0B
- Unilateral adrenal hyperplasi DE26.8
- Familiær hyperaldosteronisme type I, II og III DE26.8
Hvad omfatter denne NBV ikke
Ektopisk aldosteron producerende tumorer DE26.8
Forekomst
Prævalensen af Primær Hyperaldosteronisme (PHA) blandt patienter med hypertension varierer betydeligt i forskellige studier, bl. a. afhængigt af selektion. Estimater på prævalens givet hypertension varierer fra median 6% (range 4,6-12,7%, n=5 studier) i prospektive studier i primærsektoren over median 6,4% (range 1,0-18,0%, n=16) i prospektive studier fra henvisningscentre til median 18,9% (range 15,2-29,8%, n=4) blandt patienter med resistent hypertension i prospektive studier fra henvisningscentre (1). Andre angiver prævalens hos patienter med hypertension på 5-10% (og måske højere (2)).
Sammenlignet med patienter med essentiel hypertension har patienter med PHA øget risiko for apopleksi (odds ratio 2,58 (CI 1,93-3,45)), iskæmisk hjertesygdom (1,77 (1,10-2,83)), atrieflimren (3,52 (2,06-5,99)) og hjertesvigt (2,05 (1,11-3,78)) (3) om end data altovervejende bygger på mere end 10 år gamle studier (4).
Klinisk præsentation
PHA mistænkes typisk hos patienter med hypertension og hypokaliæmi. Hvis en patient ikke har hypertension, er der ingen grund til at mistænke PHA. Mens hypertension er prævalent hos stort set alle på diagnosetidspunktet ses hypokaliæmi kun i de sværere tilfælde og hypokaliæmi har lav sensitivitet (tilstede hos 9-37% af PHA patienter). Fravær af hypokaliæmi har således lav negativ prædiktiv værdi for PHA (2).
Biokemiske fund og symptomatologi er generelt sværere hos patienter med adenomer end hos patienter med hyperplasi.
Som følge af hypokaliæmi kan der udvikles metabolisk alkalose. Typisk ses også let hyper-natriæmi og hyper-kloridæmi.
PHA er oftest symptomfattig; det forhøjede BT kan manifestere sig ved hovedpine og ved hypokalæmi kan ses træthed, polyuri, polydipsi, cardielle arrytmier og muskelgener (specielt muskelinsufficiens).
Hvem foreslås undersøgt for PHA? (2)
Vurdering af hvilke patienter, der anbefales udredt, må individualiseres med fokus på patienter, der vil kunne profitere af operation eller specifik behandling.
- Veldokumenteret (ubehandlet) hypertension, BT > 150/100 – døgn BT måling eller målt hjemme på 3 forskellige dage (PHA prævalens: BT 140-159/90-99: 2%; BT 160-179/100-109: 8%; BT >180/110: 13%)
- BT > 140/90 trods behandling med 3 antihypertensiva inklusive evt. diuretikum (PHA prævalens 17-23%)
- Behov for behandling med 4 eller flere antihypertensiva
- Hypertension og spontan hypokaliæmi
- Debut af hypertension før 40 års alder
- Hypertension og binyre incidentalom (PHA prævalens 1,1-10%, median 2%)
- Hypertension og familie anamnese med tidligt indsættende hypertension eller cerebrovaskulær katastrofe i ung alder (< 40 år)
- Alle hypertensive førstegradsslægtninge til patienter med PHA
Biokemisk præsentation
Ved mistanke om PHA udføres som screeningsundersøgelse måling af p-aldosteron koncentration og p-renin koncentration eller p-renin aktivitet. Resultatet af undersøgelserne angives som aldosteron/renin-ratio (ARR) hvor en høj værdi understøtter mistanken om autonom aldosteron produktion.
Forberedelse:
Hos flertallet af patienter skal den antihypertensive behandling ændres før måling af aldosteron/renin ration (ARR), se nedenstående afsnit vedr. interaktioner.
Inden måling af ARR skal hypokaliæmi korrigeres og der tilstræbes rigelig indtagelse af natrium mhp. at øge undersøgelsens sensitivitet (2).
Vi vil anbefale at målinger med IDS ISYS assay (se senere) foretages i morgentimerne (kl 07-10) og efter almindelig oppegående aktivitet (minimum 30 minutter) samt 5-10 minutters siddende hvile. Det anbefales også af andre (2) i forhold til prøver taget efter 30 min liggende hvile for at opnå høje koncentrationer af aldosteron og dermed reducere risikoen for falsk negative resultater (5-8). Denne fremgangsmåde synes ikke at påvirke specificiteten nævneværdigt (6).
Analyse metode: I hele landet anvendes ImmunoDiagnosticSystems (IDS) integrated system (ISYS) kemiluminometriske assay. Referenceintervallet er baseret på (22), som også er firmaets (IDS’) opgivne og fremgår af Analysefortegnelsen.dk.
, professor Aase Handberg).
Interaktion med lægemidler:
Data vedrørende lægemidlers indvirkning på renin-angiotensin-aldosteron-systemet (RAAS) inklusiv ARR er overvejende indhentet på raske forsøgspersoner og patienter med hypertension uden autonom aldosteronproduktion. Derimod er det kun sparsomt belyst, hvilken indflydelse forskellige lægemidler har på ARR ved PHA (6;9-12). Det anbefales derfor at måling af ARR så vidt muligt foretages uden indtagelse af lægemidler, der kan influere RAAS (Tabel 1 (2)).
Såfremt det ikke er muligt helt at omlægge den antihypertensive behandling, skal pausering af diuretika prioriteres (2). Bestemmelse af ARR giver ikke mening under pågående behandling med kalium besparende diuretika (11). Forhøjet ratio under pågående behandling med ACE-inhibitorer eller angiotensin II-receptorantagonister understøtter mistanken om PHA.
Tabel 1.
| Lægemidler og forhold, der påvirker aldosteron/renin ratio (ARR) | Ændring i ARR | Anbefalet pause inden måling |
| Kalium besparende diuretika | Reduceres (FN) | 4 uger |
| Loop og thiazid diuretika | Reduceres (FN) | 4 uger |
| ACE-inhibitorer | Reduceres (FN) | 2 uger |
| Angiotensin II-receptorantagonister | Reduceres (FN) | 2 uger |
| Dihydropyridin calciumantagonister (Amlodipin, Felopdipin, Isradipin, nifedipin (Adalat®)) | Reduceres (FN) | 2 uger |
| α-receptor agonister (clonidin; α-methyldopa) | Øges (FP) | 2 uger |
| β-blokkere | Øges (FP), appendix | 2 uger |
| NSAID | Øges (FP) | 2 uger |
| Peroral indtaget østrogen Glycyrrhizinsyre (lakridsrodsprodukter) Hypokaliæmi Natrium loading Nedsat nyrefunktion Alder (>65 år) | Usikkert, appendix Usikkert, appendix Reduceres (FN) Øges (FP) Øges (FP) Øges (FP) | 6 uger 4 uger
|
| Antihypertensiva der kan anvendes | ||
| α-receptor antagonister (Doxazosin) | ||
| Non-dihydropyridin calciumantagonister (Verapamil, Diltiazem)
centralt virkende antihypertensivum (Moxonidin) | ||
FP: falsk positiv; FN: falsk negativ (tabel modificeret efter 2, 13, 14, 19)
Interferens: Indtag af biotin vil påvirke målingerne af renin og aldosteron.
Tolkning af ratio
Der anbefales i Danmark (IDS ISYS assay), aktuelt følgende ARR cut-off værdi:
| p-renin konc. (mIU/L) | |
| p-aldosteron (pmol/L) | 31 |
Nyligt er foreslået væsentlig højere værdi for ARR hos kvinder end hos mænd (19), men vi har valgt fortsat at have samme ARR cutt-of hos begge køn. Hos ovulerende kvinder anbefales dog at undersøgelsen foretages i follikulær fasen af menstruationscyklus (19).
Med high-sensitive analysemetoder for p-renin og reninaktivitet kan der bestemmes meget lave reninniveauer. Det medfører at aldosteron/renin-ratio kan være forhøjet ved lave koncentrationer af aldosteron (fx 100 pmol/l), der ikke umiddelbart er forenelig med PHA. Der er ikke konsensus omkring et minimumsniveau for p-aldosteron (2;18), men i et stort australsk materiale på 125 patienter med operativt verificeret aldosteron producerende adenom fandt man at kun 4% havde ikke-hvilende p-aldosteron <278 pmol/l (11).
Ved måling af høje aldosteron værdier og normale renin værdier kan findes ARR over cut-off grænsen hos personer, der ikke har PHA. Derfor anbefales en øvre cut-off værdi for renin over hvilken diagnosen PHA er usandsynlig. I et nyligt arbejde med kun 16 PHA patienter er en grænse på 14,2 fundet at give en diagnostisk sensitivitet på 100% og en diagnostisk specificitet på 84% (19). Da der ikke foreligger yderligere data foreslår gruppen at en cut-off værdi på 20 mIU/L anvendes
Anbefalinger ved måling af aldosteron/renin-ratio til screening for PHA:
- Hypokaliæmi skal korrigeres forud for måling
- Kaliumbesparende diuretika skal pauseres mindst 4 uger før måling
- Lægemidler, der påvirker aldosteron/renin-ratio, bør pauseres
- Aldosteron/renin-ratio måles om morgenen i siddende stilling forudgået af almindelig aktivitet
- Plasma renin koncentration og plasma renin aktivitetsmåling er ligeværdige analysemetoder
- Cut-off for aldosteron/renin-ratio er assay specifik
- Forhøjet aldosteron/renin-ratio med p-aldosteron < 240 pmol/l l eller p-renin > 20 mIU/l (19) (begge målt med IDS ISYS assay) taler imod PHA og andre diagnoser skal overvejes.
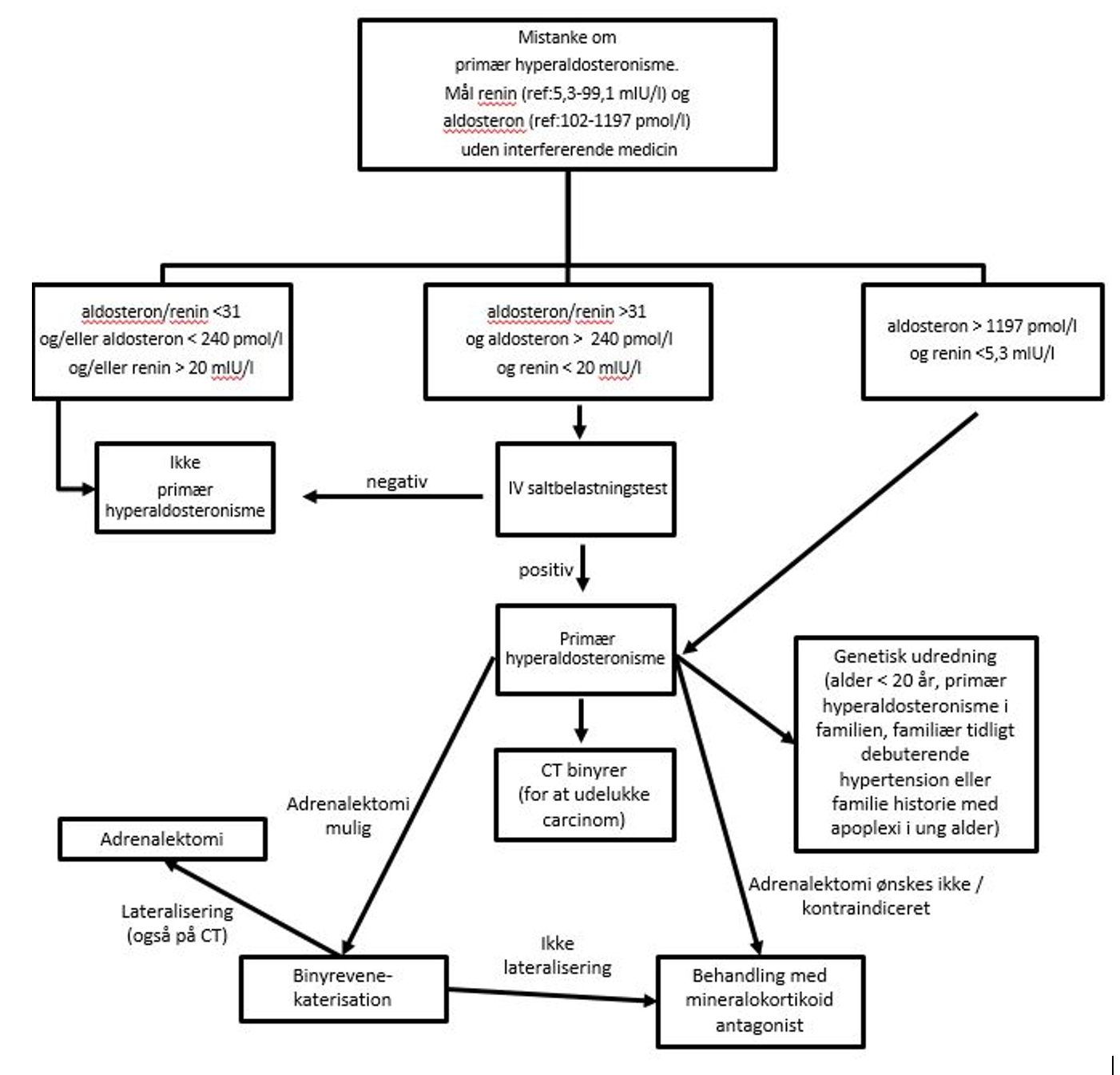
Diagnose (figur 1)
Såfremt der foreligger forhøjet ARR eller vanskelig tolkelig ARR anbefales patienten henvist til videre udredning i et højt specialiseret center, jf. specialeplanen.
PHA diagnosticeres hos patienter med forhøjet ARR (>31 (IDS ISYS assay)), supprimeret renin og uhensigtmæssigt forhøjet aldosteron (se figur 2). Hos patienter med intermediære aldosteronværdier (240-1197 pmol/l (IDS ISYS assay)) er der behov for en bekræftende test (se nedenfor). På trods af at nyeste guideline fra Endocrine Society (2) ikke sætter en sikker nedre grænse for aldosteron synes PHA i daglig klinisk virke at være usandsynlig ved plasma aldosteron < 240 pmol/l (IDS ISYS assay). PHA er usandsynligt ved renin > 20 mIU/L (IDS ISYS assay).
a) Bekræftende test:
Hos patienter med ARR >31 pmol/l / mIU/l, aldosteron 240- 1197 pmol/l og renin < 20 mIU/L (begge v/IDS ISYS assay) er der behov for en bekræftende test før diagnosen PHA kan stilles. Der er ingen gylden standard, og det afspejles i, at der for de 3 hyppigst anvendte test (iv saltbelastningstest, florinef test og captopril test) findes forskellige fremgangsmåder samt aldosteron cut-offs for hver enkelt test (2).
Da det primære formål med en bekræftende test for PHA er at udelukke falsk positive ARR værdier, er der behov for en test med høj negativ prædiktiv værdi. Dette forhold samt tendenser i guidelines (2, 20) sammenholdt med en proceduremæssig let gennemførlig test gør, at siddende iv saltbelastningstest anbefales som førstevalg (se nedenfor).
Florinef suppresions test angives også at have høj negativ prædiktiv værdi (20), men den er mere besværlig at udføre. Testen beskrives i appendix.
I tilfælde af kontraindikationer (betydende nyre- eller hjertesvigt, ukontrolleret hypertension) til iv saltbelastningstest eller florinef suppressions test anbefales evt. captopril suppressionstest (2, 20), der beskrives i appendix
Faktaboks (IDS ISYS assay):
| IV saltbelastningstest (44): Med patienten i siddende stilling i 15 min indgives (med start mellem kl 08 og 9.30) 2 L 0.9 % NaCl iv over 4 timer (dråbetæller) og patienten forbliver i siddende stilling(toiletbesøg senest 30 min før blodprøvetagning accepteres). Der måles puls og blodtryk hver time. Før og efter endt infusion måles plasma aldosteron, renin og kortisol. Plasma aldosteron (efter infusion) < 170 pmol/l udelukker PHA (44). |
Der er nyligt og især hos patienter med bilateral sygdom stillet spørgsmålstegn ved IDS ISYS assayets præcision, idet assay synes at måle for højt sammenlignet med væskekromatografi-massespektrometriske (LC-MS) målinger (44). Det kan derfor overvejes ved positiv konfirmerende test at få foretaget analyse for aldosteron med LC-MS, der for nærværende udføres på Sygehus Lillebælt i Vejle.
Subtypeklassifikation:
Når diagnosen PHA er stillet er der behov for subtypeklassifikation. Subtypeklassifikationen har til formål skelne de unilaterale (og hermed de potentielt kirurgisk behandlelige tilstande) fra de bilaterale tilstande (som skal medicinsk behandles). Hos potentielle operationskandidater anbefales binyrevenekaterisation (BNVK) til subtypeklassifikation.
Figur 1: Flow chart for udredning af PHA (siddende måling (IDS ISYS assay værdier)).
b) Billeddiagnostik
Der anbefales binyre CT skanning. CT-scanning af binyrerne er den bedst evaluerede radiologiske undersøgelsesteknik ved adrenale tumorer. MR skanning frembyder ingen fordele.
CT skanning er ikke diagnostisk for PHA men bruges som beslutningsstøtte og for at udelukke det sjældne carcinom.
CT skanning kan således påvise både normale forhold, uni- eller bilateralt adenom eller hyperplasi.
Ved adenomer > 4 cm eller specifikke maligne karakteristika må malignitet mistænkes og tumor anbefales fjernet. (link til NBV incidentalom). Aldosteron producerende binyre adenomer er ekstremt sjældent maligne.
Ved tumorer større end 1 cm suppleres med dexametason suppressions og ved kortisol > 50 nmol/ltest overvejelser ved tolkning af BNVK og ”steroid paraply” (2) ved evt adrenalektomi
b) Binyrevene katerisation
Ved etableret PHA er undersøgelse for om der foreligger unilateral eller bilateral sygdom afgørende før definitiv beslutning om behandling. Påvisning af lateralisering af aldosteron overproduktion foretages ved binyre vene katerisation (BVNK).
BVNK bør kun udføres, når diagnosen PHA er stillet og såfremt patienten er interesseret i respektiv er kandidat til et evt. kirurgisk behandlingstilbud.
BVNK foretages af en interventionsradiolog. Kateter indføres i vena femoralis (lokal anæstesi) og avanceres først til højre binyrevene – ca 90o indløb i vena cava – og derefter opsøges venstre binyrevene. Der tages prøver til p-aldosteron og p-kortisol samt undertiden metanefriner koncentration fra begge binyrevener (dobbeltbestemmelse) samt fra vena iliaca og tillige evt. fra perifer cubital vene. Undersøgelsen foretages i Danmark uden ACTH stimulation.
Tolkning af BVNK (24, 25):
Hvorvidt der foreligger lateraliseret aldosteron overproduktion fra én binyre afgøres ved dels at afgøre om binyrevene prøven er god nok (selektiv), dels at der er overproduktion fra den ene side (lateralisering) samtidig med suppression af den anden side. Hertil benyttes:
Selektivitets-index, dvs foreligger en brugbar binyre vene prøve:
p-kortisol i binyre vene ≥2 i forhold til perifer vene. Ved kortisoloverskud da evt metanefrinratio > 12
Hvis dette ikke er tilfældet bør BVNK gentages.
Lateraliserings-index:
(Aldosteron/kortisol) dominant side / (aldosteron/kortisol) ikke dominant side ≥ 4
Én guideline anvender lateraliserings-index ≥2 ved ustimuleret BVNK (24), men vi har i lighed med den franske guideline valgt værdien ≥4 for at øge antallet af helbredte ved adrenalektomi og for ikke at operere for mange unødvendigt (25).
Kontralateral–suppressions-index:
(aldosteron/kortisol) ikke dominant side/ (aldosteron/kortisol) perifer < 1
Suppresions-index vil ikke altid være opfyldt.
Der må ved konference foretages en samlet vurdering af BNVK resultaterne og der må i det individuelle tilfælde vurderes, om der er tilstrækkelig eller utilstrækkelig evidens for ensidig aldosteron overproduktion. De anførte indices er derfor kun vejledende.
Der må endelig i det individuelle tilfælde konfereres i det højt specialiserede center, hvorvidt patienten skal tilbydes adrenalektomi.
Komplikationer ved BNVK er blødning, infektion, binyre vene ruptur (ca 0,6% hyppighed), binyrevene trombose, vene dissektion og ultimativt total binyreinsufficiens (24). BVNK anbefales kun at foregå på få interventionsradiologiske centre.
c) Genetisk testning (2)
Alle hypertensive førstegrads slægtninge til patienter med PHA bør tilbydes udredning for PHA.
Patienter diagnosticeret med PHA før 20 års alderen eller med hæmoragisk cerebralt insult før 40 års alderen samt patienter med familiær ophobning af PHA bør genetisk udredes for én af de tre arvelige (autosomalt dominante) former, hhv. familiær hyperaldosteronisme type I (glukokortikoid supprimerbar hyperaldosteronisme), type II, type III og type IV. Hver enkelt form udgør under 1 % af det samlede antal patienter diagnosticeret med PHA.
Unge PHA patienter (<20 år) anbefales tillige udredt for somatiske mutationer i KCNJ5, ATP1A1, ATP2B3 og CACNA1D genet. De er yderst sjældne.
Behandling
Ved unilateral sygdom anbefales adrenalektomi, som ser ud til at forbedre prognosen (26), er medicinbesparende og giver større patienttilfredshed (23). Ellers behandles medicinsk.
Operativ behandling og opfølgning
Når de diagnostiske undersøgelser er færdige og indtil operation kan blodtrykket kontrolleres med mineralocorticoid receptor antagonist, primært spiron alternativt eplerenon hvis spiron giver bivirkninger og evt. ikke tåles. Derudover kan suppleres med andre antihypertensiva og evt kalium tilskud.
Mineralocorticoid receptor antagonist seponeres umiddelbart postoperativt
Kaliumtilskud reduceres/seponeres fra umiddelbart efter operation.
En uge postoperativt måles p-kalium og kreatinin .
Aldosteron og renin måles 4 uger postoperativt (obs præoperativ Spironbehandling).
Med lille hyppighed, 5%, ses behandlingskrævende postoperativ hypo-aldosteronisme (28) som i 11-46 måneder postoperativt krævede mineralocorticoid behandling. Risikofaktorer synes at være alder og nedsat nyrefunktion mens præoperativ mineralocorticoid antagonist behandling ikke betød noget.
Der ses også kreatininstigning betinget af bortfald af den aldosteron-betingede renale hyperfiltration (som har givet falsk nedsat kreatinin præ-operativt) (29).
Ved forhøjet ARR da ny bekræftende test efter ca 3 måneder mhp på remission eller vedholdende sygdom, som tegn på at PHA var bilateral og den unilaterale sygdom ikke var korrekt diagnosticeret.
Postoperativt vil størstedelen af patienterne kunne ophøre med kaliumtilskud ligesom den antihypertensive behandling oftest kan reduceres eller seponeres.
Udfaldet efter adrenalektomi vurderes på både kliniske og biokemiske variable (30):
Komplet klinisk succes: Normalt blodtryk uden anti-hypertensiva
Partiel klinisk succes: Samme blodtryk som før operation men med færre anti-hypertensiva eller lavere blodtryk med samme mængde anti-hypertensiva.
Ingen klinisk succes: Uændret eller stigende blodtryk med samme mængde anti-hypertensiva.
Komplet biokemisk succes: Korrektion af hypokaliæmi og normalisering af ARR.
Partiel biokemisk succes: Korrektion af hypokaliæmi og forbedring af ARR (evt ny bekræftende test)
Ingen biokemisk succes: Vedholdende hypokaliæmi og/eller uændret ARR (evt ny beskræftende test)
Udfaldet vurderes først 3 måneder postoperativt og endeligt efter 12 måneder.
Komplet klinisk succes ses hos 17-62% og komplet biokemisk succes hos 94% (30)
Efter 1 år kan succesfuldt opererede patienter følges hos praktiserende læge med årlige målinger af BT og K (30).
Medicinsk behandling og opfølgning
Patienter, hvor unilateral hypersekretion ikke har kunnet verificeres, samt patienter, der af andre årsager ikke anbefales adrenalektomi, behandles medicinsk.
Disse patienter fortsætter aldosteron receptorblokade, med spiron eller eplerenon. Der foreligger eet dobbelt blindt randomiseret og 2 ublindede randomiserede studier, som sammenligner spiron med eplerenon til antihypertensiv behandling ved PHA (31-33). Den antihypertensive effekt af spiron er højere end eplerenon. Spiron, som er dobbelt så potent per vægtenhed som eplerenon, doseres én gang dagligt til et måltid. Eplerenon doseres 2 gange dagligt og påvirkes ikke af fødeindtagelse (34). Det er gruppens opfattelse at eplerenon oftest underdoseres og bør bruges i mere udbredt grad.
Typiske startdoser:
Spironolakton 25 mg x 1 og Eplerenon 25 mg x 2. Med optitrering efter blodtryk og kalium (max-doser anvendt i studier er 400 mg/dag for Spiron og 300 mg/dag for Eplerenon .
Bivirkningerne til spironolakton i form af gynækomasti, mastalgi, træthed, nedsat libido er klart mere udtalte end for eplerenone. Ved bivirkninger til spironolakton skiftes til eplerenon (som anvendes off-label på indikationen PHA). Derudover anvendes andre antihypertensiva, f.eks. calciumantagonister og evt. kalium tilskud.
Da ikke-supprimeret renin forbedrer prognosen ved medicinsk-behandlet PHA (26) anbefales at behandlingen justeres i forhold til renin, kalium og blodtryk.
Yderligere billediagnostik eller hormonel opfølgning er oftest ikke indiceret.
Velbehandlede patienter kan følges hos praktiserende læge med årlige målinger af BT og K og kan genhenvises ved stigende blodtryk eller udvikling af bivirkninger til den medicinske behandling.
Appendix
a) Vedr. Analyse metoder
Traditionelt har renin været udtrykt som renin aktivitet. Renin aktivitet bestemmes ud fra generering af angiotensin I ved inkubation af plasma med angiotensinogen. I analysen anvendes således et antistof rettet mod angiotensin I. I de senere år er mange kommercielt tilgængelige målemetoder taget i anvendelse, også i DK, der direkte måler p-renin koncentration. De er mindre arbejdskrævende og kan anvendes på automatiserede maskiner med bedre mulighed for standardisering. Ved sammenlignende undersøgelser af renin-aktivitet vs. p-renin som screeningsværktøj synes de to analysemetoder at producere sammenlignelige resultater (7, 9, 33-35).
Plasma aldosteron måles fortrinsvis med immunbaserede metoder på automatiserede maskiner. Der er betydelig variation fra assay til assay, hvor p-aldosteron fra samme prøve kan variere med en faktor 2 (39). Massespektrometri har været foreslået som en alternativ og mere pålidelig analysemetode, men anvendes aktuelt ikke rutinemæssigt udover Sygehus Lillebælt i Vejle (10).
b) Vedr. lægemiddel interaktioner
Det har været fremført at p-renin måling, i modsætning til reninaktivitet, er påvirkelig af østrogenstatus således at højt østrogenniveau (lutheal fase i menstruationscyklus og peroral antikonception) medfører nedsat p-renin med risiko for falsk positive resultater. (1, 19, 36, 37).. Det er dog ikke alle undersøgelser der har kunnet påvise en klinisk betydende indvirkning af østrogen på p-aldosteron/p-renin-ratio (6).
Det er mht perorale antikonceptiva påvist at nogle gestagener synes at blokere mineralocorticoid recptoren og medføre forøgede p-aldosteron koncentrationer (19)
β-receptor blokerende lægemidler har en direkte supprimerende effekt på renin syntesen, der ikke modsvares af et tilsvarende fald i p-aldosteron hvorfor aldosteron/renin-ratio stiger. Nogle undersøgelser har vist at behandling med β-blokkere har klinisk relevans med markant risiko for falsk positiv ratio (12, 40) mens andre undersøgelser tyder på en beskeden effekt, der ikke har diagnostisk betydning (6, 9, 41).
170 pmol/L bekræfter PHA diagnosen såfremt p-renin er under detektionsgrænsen og p-kortisol kl 10 er lavere end kl 07. ” v:shapes=”Text_x0020_Box_x0020_59″>Produkter der indeholder glycyrrhizinsyre (lakridsrod) bør pauseres i mindst 4 uger (2). Glycyrrhizinsyre nedsætter både p-aldosteron og p-renin.
Florinef suppressions test (2, 24): Udføres under indlæggelse. Starter kl 08:00. Der gives tbl florinef® 0,1 mg hver 6. Time i 4 dage. Der måles s-K hver 6. time og administreres kalium tilskud med mixt. kaliumklorid således s-K er tæt på 4,0 mmol/L. Derudover administreres natriumklorid tbl 30 mmol (1,75 g) x 3 dagligt under testen. Dag 4 tages p-kortisol kl 07:00 og kl 10:00 hvor testen afsluttes med at måle siddende p-aldosteron og p-renin.
P-aldosteron > 170 pmol/L bekræfter PHA diagnosen såfremt p-renin er under detektionsgrænsen og p-kortisol kl 10 er lavere end kl 07.
Captopril suppresions test (2): Kan udføres ambulant. Patienten sidder i 1 time. Derefter indtages tbl captopril 50 mg til tiden 0 og patienten bliver siddende. Til tiden 0, 60 min og 120 min udtages blodprøve til p-aldosteron og p-renin.
Guidelines (2) anbefaler cutt-off således at p-aldosteron personer uden PHA supprimeres mere end 30%. Referencen til denne værdi kan ikke findes. Nyere studier i kinesiske personer (42, 43) peger på at absolut p-aldosteron værdi er mere anvendelig, men der foreligger ikke tilsvarende undersøgelser i kaukasiske personer. Indtil videre anbefales derfor at p-aldosteron skal falde mere end 30%, men fundene må tolkes med forsigtighed.
Patienter med aldosteron producerende adenom supprimerer typisk mindre end patienter med hyperplasi
Referencer
- Käyser SC, Dekkers T, Groenewoud HJ, van der Wilt GJ, Carel Bakx J, van der Wel MC, Hermus AR,Lenders JW, Deinum J Study Heterogeneity and Estimation of Prevalence of Primary Aldosteronism: A Systematic Review and Meta-Regression Analysis. J Clin Endocrinol Metab 101(7):2826-35
- Funder JW, Carey RM, Mantero F, Murad MH, Reincke M, Shibata H, Stowasser M, Young WF, Jr. 2016 The Management of Primary Aldosteronism: Case Detection, Diagnosis, and Treatment: An Endocrine Society Clinical Practice Guideline. J Clin Endocrinol Metab 101:1889-1916
- Monticone S, D’Ascenzo F, Moretti C, Williams TA, Veglio F, Gaita F, Mulatero P 2018 Cardiovascular events and target organ damage in primary aldosteronism compared with essential hypertension: a systematic review and meta-analysis. Lancet Diabetes Endocrinol; 6:41-50
- Funder JW 2018 Primary aldosteronism and cardiovascular risk, before and after treatment. Lancet Diabetes Endocrinol 6:5-7
- Espiner EA, Ross DG, Yandle TG, Richards AM, Hunt PJ 2003 Predicting surgically remedial primary aldosteronism: role of adrenal scanning, posture testing, and adrenal vein sampling. J Clin Endocrinol Metab 88:3637-3644
- Pilz S, Kienreich K, Gaksch M, Grubler M, Verheyen N, Bersuch LA, Schmid J, Drechsler C, Ritz E, Moosbrugger A, Stepan V, Pieber TR, Meinitzer A, Marz W, Tomaschitz A 2014 Aldosterone to active Renin ratio as screening test for primary aldosteronism: reproducibility and influence of orthostasis and salt loading. Horm Metab Res 46:427-432
- Glinicki P, Jeske W, Bednarek-Papierska L, Kruszynska A, Gietka-Czernel M, Roslonowska E, Slowinska-Srzednicka J, Kasperlik-Zaluska A, Zgliczynski W 2014 The ratios of aldosterone / plasma renin activity (ARR) versus aldosterone / direct renin concentration (ADRR). J Renin Angiotensin Aldosterone Syst……
- Kem DC, Weinberger MH, Gomez-Sanchez C, Kramer NJ, Lerman R, Furuyama S, Nugent CA 1973 Circadian rhythm of plasma aldosterone concentration in patients with primary aldosteronism. J Clin Invest 52:2272-2277
- Unger N, Lopez S, I, Pitt C, Walz MK, Philipp T, Mann K, Petersenn S 2004 Comparison of active renin concentration and plasma renin activity for the diagnosis of primary hyperaldosteronism in patients with an adrenal mass. Eur J Endocrinol 150:517-523
- Stowasser M, Ahmed AH, Pimenta E, Taylor PJ, Gordon RD 2012 Factors affecting the aldosterone/renin ratio. Horm Metab Res 44:170-176
- Gallay BJ, Ahmad S, Xu L, Toivola B, Davidson RC 2001 Screening for primary aldosteronism without discontinuing hypertensive medications: plasma aldosterone-renin ratio. Am J Kidney Dis 37:699-705
- Seifarth C, Trenkel S, Schobel H, Hahn EG, Hensen J 2002 Influence of antihypertensive medication on aldosterone and renin concentration in the differential diagnosis of essential hypertension and primary aldosteronism. Clin Endocrinol (Oxf) 57:457-465
- Ahmed et al JCEM 2017, p 2039-2043
- Mulatero P, Rabbia F, Milan A, Paglieri C, Morello F, Chiandussi L, Veglio F 2002 Drug effects on aldosterone/plasma renin activity ratio in primary aldosteronism. Hypertension 40:897-902
- Chao CT, Wu VC, Kuo CC, Lin YH, Chang CC, Chueh SJ, Wu KD, Pimenta E, Stowasser M 2013 Diagnosis and management of primary aldosteronism: an updated review. Ann Med 45:375-383
- Manolopoulou, J, Fischer, E, Dietz, A, Diederich, S, Holmes, D, Junnila, R, Grimminger, P, Reincke, M, Morganti, A, Bidlingmaier, M Clinical validation for the aldosterone-to-renin ratio and aldosterone suppression testing using simultaneous fully automated chemiluminescence immunoassays. J Hypertens 33 (12): 2500–11
- Douillard C, Houillier, Nussberger J, Girerd X SFE/SFHTA/AFCE Consensus on Primary Aldosteronism, part 2: First diagnostic steps. Ann Endocrinol 77:192-201
- Fuller PJ 2013 Adrenal Diagnostics: An Endocrinologist’s Perspective focused on Hyperaldosteronism. Clin Biochem Rev 34:111-116
- O’Shea PM, Griffin TP, Browne GA, Gallagher N, Brady JJ, Dennedy MC, Bell M, Wall D, Fitzgibbon Screening for primary aldosteronism using the newly developed IDS-iSYS® automated assay system. Prac Lab Med 7:6-14
- Reznik Y, Amar L, Tabarin A SFE/SFHTA/AFCE Consensus on Primary Aldosteronism, part 3: Confirmatory testing. Ann Endocrinol 77:202-7
- Ahmed AH, Cowley D, Wolley M, Gordon RD, Xu S, Taylor PJ, et al. Seated saline suppression testing for the diagnosis of primary aldosteronism: a preliminary study. J Clin Endocrinol Metab 99: 2745-53
- Mulatero P, Milan A, Fallo F, Regolisti G, Pizzolo F, Fardella C, et al. 2006. Comparison of confirmatory tests for diagnosis of primary aldosteronism. J Clin Endocrinol Metab 91:2618-23
- Dekkers T, Prejbisz A, Kool LJ, Groenewoud HJ, Velema M, Spiering W, Kołodziejczyk-Kruk S, Arntz M, Kądziela J, Langenhuijsen JF, Kerstens MN, van den Meiracker AH, van den Born BJ, Sweep FC, Hermus AR, Januszewicz A, Ligthart-Naber AF, Makai P, van der Wilt GJ, Lenders JW, Deinum J, SPARTACUS Investigators Adrenal vein sampling versus CT scan to determine treatment in primary aldosteronism: an outcome-based randomised diagnostic trial. Lancet Diabetes Endocrinol 4:739-46
- Rossi GP, Auchus RJ, Brown M, Lenders JWM, Naruse M, Plouin PF, Satoh F, Young WF Jr. An expert consensus statement on use of adrenal vein sampling for the subtyping of primary aldosteronism. Hypertension; 63:151-160
- Bardet S, Chamontin B, Douillard C, Pagny JY, Hernigou A, Joffre F, Plouin PF, Steichen O SFE/SFHTA/AFCE Consensus on Primary Aldosteronism, part 4: Subtype diagnosis. Ann Endocrinol 77:208-13
- Hundemer GL, Curhan GC, Yozamp N, Wang M, Vaidya A Cardiometabolic outcomes and mortality in medically treated primary aldosteronism: a retrospective cohort study. Lancet Diabetes Endocrinol 6:51-9
- Heinrich DA, Adolf C, Holler F, Lechner B, Schneider H, Riester A, Nirschl N, Sturm L, Wang X, Ladurner R, Seidensticker M, Bidlingmaier M, Beuschlein F, Reincke M 2019. Adrenal insufficiency after unilateral adrenalectomy in primary aldosteronism – long-term outcome and clinical impact. J Clin Endocrinol Metab
- Fischer E, Hanslik G, Pallauf A, Degenhart C, Linsenmaier U, Beuschlein F, Bidlingmaier M, Mussack T, Ladurner R, Hallfeldt K, Quinkler M, Reincke M 2012. Prolonged Zona Glomerulosa Insufficiency Causing Hyperkalemia in Primary Aldosteronism after Adrenalectomy. J Clin Endocrinol metab 97:3965-73
- Kobayashi H, Abe M, Nakamura Y, Takahashi K, Fujita M, Takeda Y, Yoneda T, Kurihara I, ItohH, Tsuiki M, Wada N, Ichijo T, Katabami T, Ogawa Y, Kawashima J, Yoshimoto T, Sone M, Inagaki N, Watanabe M, Kamemura K, Matsuda Y, Izawa S, Tanabe M, Tanabe A, Suzuki T, Naruse M Association Between Acute Fall in Estimated Glomerular Filtration Rate After Treatment for Primary Aldosteronism and Long-Term Decline in Renal Function. Hypertension 74: 630-8
- Williams TA, Lenders JWM, Mulatero P, Burello J, Rottenkolber M, Adolf C, Satoh F, et al Outcomes after adrenalectomy for unilateral primary aldosteronism: an international consensus on outcome measures and analysis of remission rates in an international cohort. Lancet Diabetes Endocrinol 5:689-99
- Karagiannis A, Tziomalos K, Papageorgiou A, Kakafika AI, Pagourelias ED, Anagnostis P, Athyros VG, Mikhailidis DP Spironolactone versus eplerenone for the treatment of idiopathic hyperaldosteronism. Expert Opin Pharmacother 9: 509–15
- Parthasarathy HK, Menard J, White WB, Young WF Jr, Williams GH, Williams B, Ruilope LM, McInnes GT, Connell JM, MacDonald TM A double-blind, randomized study comparing the antihypertensive effect of eplerenone and spironolactone in patients with hypertension and evidence of primary aldosteronism. J Hypertens 29: 980–90
- Karashima S, Yoneda T, Kometani M, Ohe M, Mori S, Sawamura T, Furukawa K, Seta T, Yamagishi M, Takeda Y Comparison of eplerenone and spironolactone for the treatment of primary aldosteronismHypertension Research 39: 133–7
- Trenkel S, Seifarth C, Schobel H, Hahn EG, Hensen J 2002 Ratio of serum aldosterone to plasma renin concentration in essential hypertension and primary aldosteronism. Exp Clin Endocrinol Diabetes 110:80-85
- Ferrari P, Shaw SG, Nicod J, Saner E, Nussberger J 2004 Active renin versus plasma renin activity to define aldosterone-to-renin ratio for primary aldosteronism. J Hypertens 22:377-381
- Dorrian CA, Toole BJ, Alvarez-Madrazo S, Kelly A, Connell JM, Wallace AM 2010 A screening procedure for primary aldosteronism based on the Diasorin Liaison automated chemiluminescent immunoassay for direct renin. Ann Clin Biochem 47:195-199
- Ahmed AH, Gordon RD, Taylor PJ, Ward G, Pimenta E, Stowasser M 2011 Effect of contraceptives on aldosterone/renin ratio may vary according to the components of contraceptive, renin assay method, and possibly route of administration. J Clin Endocrinol Metab 96:1797-1804
- Ahmed AH, Gordon RD, Taylor PJ, Ward G, Pimenta E, Stowasser M 2011 Are women more at risk of false-positive primary aldosteronism screening and unnecessary suppression testing than men? J Clin Endocrinol Metab 96:E340-E346
- Schirpenbach C, Seiler L, Maser-Gluth C, Beuschlein F, Reincke M, Bidlingmaier M 2006 Automated chemiluminescence-immunoassay for aldosterone during dynamic testing: comparison to radioimmunoassays with and without extraction steps. Clin Chem 52:1749-1755
- Browne GA, Griffin TP, O’Shea PM, Dennedy MC Beta-blocker withdrawal is preferable for accurate interpretation of the aldosterone-renin ratio in chronically treated hypertension. Clin Endocrinol 84: 325-31
- Ahmed AH, Gordon RD, Taylor P, Ward G, Pimenta E, Stowasser M 2010 Effect of atenolol on aldosterone/renin ratio calculated by both plasma Renin activity and direct Renin concentration in healthy male volunteers. J Clin Endocrinol Metab 95:3201-3206
- Meng X, Li Y, Wang X, Li J, Liu Y, Yu Y 2018. Evaluation of the saline infusion test and the captopril challenge test in Chinese patients with primary aldosteronism. J Clin Endocrinol Metab 103:853-60
- Wu S, Yang J, Hu J, Song Y, He W, Yang S, Luo R, Li Q Confirmatory tests for the diagnosis of primary aldosteronism: A systematic review and meta-analysis. Vlin Endocrinol 90:641-8
- Eisenhofer G, Kurlbaum M, Pietzsch M, Constantinescu G, Remde H, Schulze M, Kaden D, Müller LM, Fuss CT, Kunz S, Kolodziejczyk-Kruk S, Gruber S, Prejbisz A, Beuschlein F, Williams TA, Reincke M, Lenders JWM, Bidlingmaier M. The Saline Infusion Test for Primary Aldosteronism: Implications of Immunoassay Inaccuracy. J Clin Endocrinol Metab 107, e2027-e2036
Tovholder
Øvrige forfattere
Ebbe Eldrup
Lise-Sofie Bislev
Eva Black
Claus Larsen Feltoft
Torben Leo Nielsen
Per Løgstrup Poulsen
Ulla Feldt Rasmussen
Randi Ugleholdt
Første version: Oktober 2016
Revideret: 2022
Næste revision: 2025