Definition
- Tilfældigt billeddiagnostisk fund af en binyretumor >1 cm, målt på korteste akse, hos patienter under udredning for anden sygdom 1
- Definitionen udelukker patienter med aktiv cancer sygdom, men da binyretumorer hyppigt påvises hos denne patientgruppe adresseres problemstillingen i denne NBV
- Tumorer <1 cm kan have betydning ved mistanke om adrenal hormon-overproduktion
- Hypertrofisk (“plump”) binyrekonfiguration har ingen betydning
Forekomst
- Binyreincidentalomer identificeres hos 1,54-7% af patienter, der undergår CT eller MR abdomen 2-6 og stiger med alderen. Over de sidste 2 dekader er set en 10-fold stigning i incidentalomer uden stigning i antal maligne tumores 3
Ætiologi
Langt størsteparten af binyreincidentalomer er benigne (97%). Ætiologi er dog stærkt afhængigt af alder og henvisningsårsag (Tabel 1) 3.
HUtom≤10 i en homogen binyretumor udelukker malignitet uafhængig af størrelse såfremt det drejer sig om et incidentalom 7.
Ved tumorer med HU > 10 er risiko for malignitet associeret med incidentalomstørrelse.
- < 4 cm: 2 % maligne
- 4 – 6 cm: 6 % maligne
- > 6 cm: 25 % adrenal carcinom og 18 % metastaser
Estimater for hormonproduktion i binyreincidentalomer varierer betydeligt fra 2%-23% 3,4,8. Årsager er bl.a. patient selektion og definition af mild autonom kortisol sekretion.
8 – 12 % kortisol producerende (langt hovedparten mild autonom kortisol sekretion)
1-5 % katekolamin producerende
1-2 % aldosteron producerende
0,1 % androgen- eller østrogen producerende
Ca. 3-8 % har anden ætiologi (hovedsageligt myelolipom, men også cyster, blødning mv)
Tabel 1: Binyretumorer generelt 3
| Maligne | |
| Efter henvisningsårsag | |
| Binyreincidentalomer | 3% |
| Cancer staging eller cancer follow-up | 43% |
| Symptomer på hormon-produktion | 3% |
| Efter alder | |
| <18 | 62% |
| 18-39 | 4% |
| 40-62 | 6% |
| ≥65 | 11% |
ICD-10 koder
Afhængigt af primær mistanke:
- D35.0 Godartet tumor i binyre
- D44.1 Ikke specificeret tumor i binyre
- Z031W Observation på mistanke om kræft i binyren.
- C74 Kræft i binyre
Symptomer og kliniske fund
Jævnfør definitionen ingen symptomer. Nærmere udspørgen / undersøgelse kan dog afsløre symptomer / fund svarende til hormonproducerende tumor.
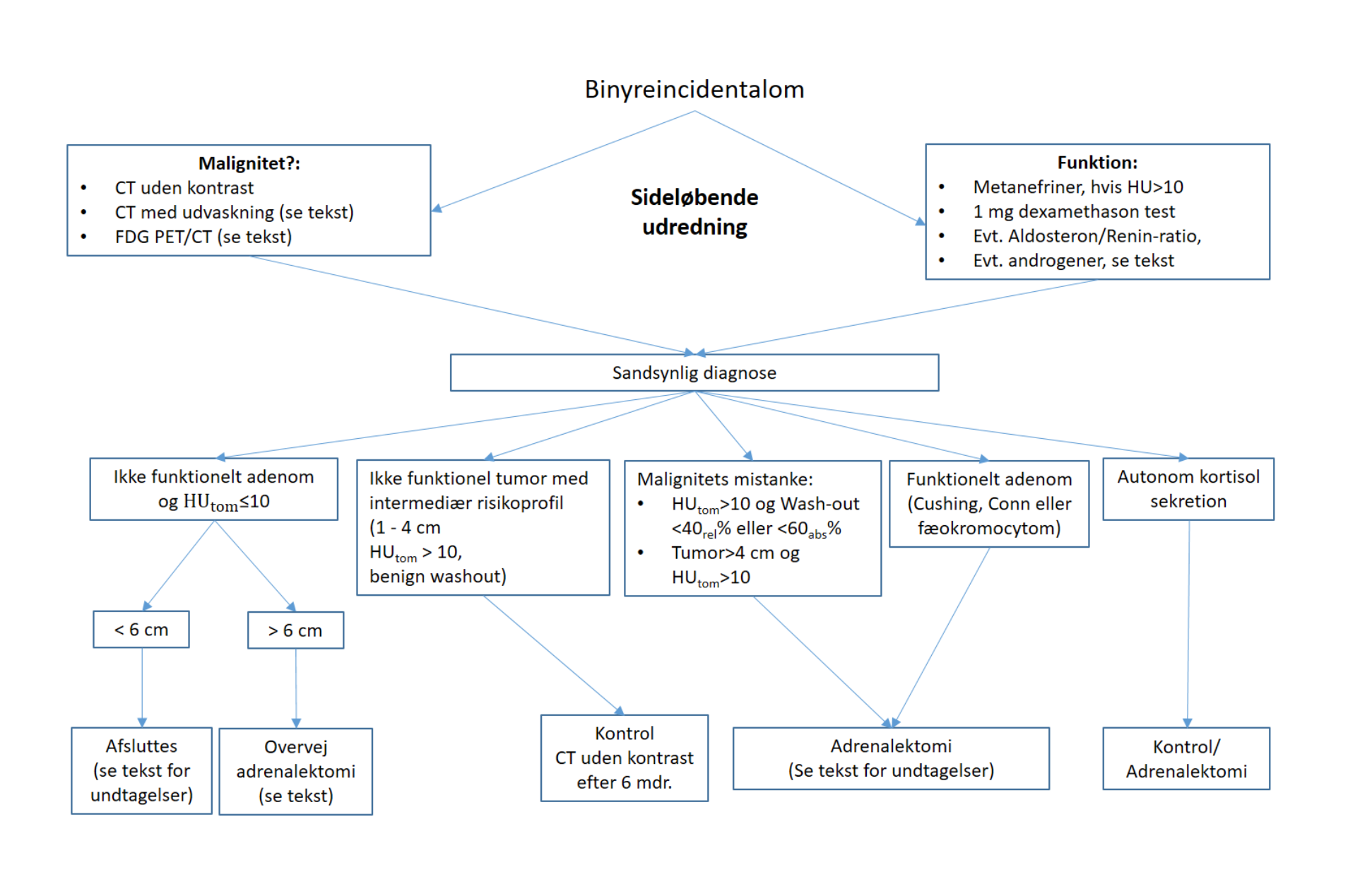
Udredning
Udredes på hovedfunktionsniveau.
Binyreincidentalomer karakteriseres med hensyn til
- Malignitet – dvs billeddiagnostisk evaluering
- Funktionel status – dvs udredning for hormonel aktivitet
1. Funktionel status – udredning for hormonsekretion
Udredning med brevsvar på binyre-CT og overnight Dexametason kan – såfremt det lokale setup tillader det – overvejes hos pt der opfylder alle af følgende kriterier:
- >40 år
- Uden kendt nylig eller aktuel malignitet
- Ikke umiddelbart opfylder vanlige kriterier for udredning for primær hyperaldosteronisme [LINK]
Patienten kan – såfremt det lokale setup tillader det – overvejes afsluttet per brev hvis:
- HUtom≤10 i en homogen binyretumor og
- Overnight dexametason suppressions test er normal.
Anamnese:
Symptomer og fund tydende på hypersekretion:
- OBS Fæokromocytom: Anfaldsfænomener [LINK]
- OBS Cushing: Myopati, Trunkal fedme, easy bruising, Striae, T2D, Osteoporose [LINK]
- OBS Hyperaldosteronisme: Hypertension (obligat), Hypokaliæmi. [LINK].
- OBS Androgenproducerende tumor: Virilisering, hirsutisme.
Medicinering: Glukokortikoid (inkl. lokalbeh.), antihypertensiva, østrogen, carbamazepin
Objektiv undersøgelse:
Særlig fokus på blodtryk, cushingoide stigmata, hirsutisme, virilisering
Biokemi:
Fæokromocytom: Udelukkes hos alle
- HUtom≤10 i en homogen binyretumor udelukker fæokromocytom 10,11.
- Ved HU-tomskanning (HUtom) ≥10 eller heterogen binyre bestemmes P-metanefriner.
Cushing: Udredning med overnight dexametason suppressions test udføres oftest og altid før adrenalektomi. Udredning skal holdes proportional med comorbiditet og alder.
- Overnight dexametason suppressionstest (1 mg dexametason kl. 23 og måling af plasma kortisol næste morgen mellem kl 8 og 9). Døgnurin for kortisol hvis overnight dexametason suppressionstest ikke kan gennemføres pga ændret metabolisering af dexametason og/eller ændring af CBG [LINK].
Hyperaldosteronisme:
Ved hypertension og under relevant pausering af medicin [LINK]. Hyperaldosteronisme er ikke meget hyppigere i en binyreincidentalom population end den generelle befolkning og udredning skal holdes proportional med den potentielle kliniske gevinst og evt. udelades hos skrøbelige/ældre patienter, der er velregulerede på antihypertensiva.
- P-aldosteron-renin-ratio.
Mænd med gynækomasti og samtidig heterogen tumor eller HU>10
- P-østradiol (Benign østradiol producerende tumor er ekstremt sjældne)
Viriliserede kvinder:
- Androgen status
Præoperativt, hvor indikationen er malignitetsmistanke:
- Døgnurin for steroidmetabolitter
- Androgenstatus ved kvinder
- P-østradiol ved mænd med gynækomasti
Bilateral hyperplasi:
- Overvej 17-OH-progesteron (basal eller ACTH stimuleret) mhp 21-hydroxylasemangel .
Medikamentel interferens: Se NBV primær hyperaldosteronisme [LINK], fæokromocytom [LINK] og NBV Binyrebarkinsufficiens [LINK].
Tolkning af hormonanalyser: Se NBV for fæokromocytom [LINK], primær hyperaldosteronisme [LINK], Cushings syndrom [LINK] og NBV Binyrebarkinsufficiens [LINK] .
Mild Autonom Kortisol Sekretion (subklinisk Cushing/subklinisk hyperkortisolisme):
En ikke entydigt defineret tilstand med øget forekomst af type 2 diabetes, hypertension, fedme, dyslipidæmi, osteoporose og forøget mortalitetsrate i forhold til incidentalompatienter uden kortisoloverskud 12.
Autonom kortisol sekretion defineres i denne NBV ud fra overnight dexametason suppressionstest hos patienter med et adrenalt incidentalom uden åbenlyse kliniske Cushing stigmata:
Biokemisk definition:
Plasma-kortisol værdier efter overnight dexametason suppressionstest
Kortisol ≤ 50 nmol/l: Ikke autonom kortisol sekretion
Kortisol 51-138 nmol/l: Mulig autonom kortisol sekretion
- Ved normal ACTH, DHEAS og døgnurin kortisol: Ikke autonom kortisol sekretion
- Ved ACTH og/eller DHEAS under nederste grænse af normalområdet og/eller forhøjet døgnurin kortisol: Autonom kortisol sekretion
Kortisol > 138 nmol/l: Autonom kortisol sekretion
Opfølgning:
Der er ingen international konsensus.
Der er minimal risiko (<1%) for progression til overt Cushing.
- Baseline: EKG, HbA1c, lipider, blodtryk, vægt og dexa-scanning samt udredning for asymptomatiske vertebrale frakturer.
- Efter 2 år: Overnight dexametason suppressionstest, BT, HbA1c, lipider, vægt og dexa-scanning samt udredning for asymptomatiske vertebrale frakturer.
Udredning for autonom kortisol sekretion skal holdes proportionalt med den potentielle kliniske gevinst, vurderes individuelt og bør udelades hos skrøbelige eller ældre patienter.
Ved stabile følgetilstande og kortisolsekretion bør forløbet afsluttes efter 2 år.
Behandling af autonom kortisol sekretion:
Følgetilstande behandles efter vanlige retningslinjer.
Adrenalektomi: Indikationen er uafklaret og må vurderes på individuel basis. Indikation styrkes af ung alder, højt kortisol (> 138 mnol/l) efter overnight Dexametason suppressionstest, ACTH/DHEAS under nederste grænse af normalområdet, flere følgetilstande, samt progression i følgetilstande og tiltagende kortisol-sekretionen.Dexametason. Før adrenalektomi skal det sikres at kortisolsekretionen er ACTH-uafhængig.
Per og postoperativt behandles med hydrokortison [LINK]
Tidligere CT og MR skanninger skal fremskaffes og gennemses, så det kan vurderes om yderligere skanning af tidligere sete binyretumorer kan udelades.
Differentiering mellem benigne og muligt maligne tumores bygger på billeddiagnostiske karakteristika
CT-skanning af binyrerne: 1,13
Den bedst evaluerede radiologiske undersøgelsesteknik ved adrenale tumorer.
En skanning af binyrerne bør indeholde følgende oplysninger:
- Tumorstørrelse målt på korteste akse samt sideplacering
- Vækst over tid. Tumoren kan ofte findes på tidligere skanninger, hvorved vækstpotentialet kan afgøres i visitation. Yderligere billeddiagnostik er unødvendig såfremt tumoren ud fra tidligere skanninger ikke er vokset i 24 mdr. Dette gælder også trods HUtom >10 og uafhængigt af udvaskning
- Morfologi (homogenicitet, afgrænsning, forkalkninger, blødning i tumor)
- HUtom (et densitetsmål, der bestemmes ved CT skanning uden kontrast (unenhanced)).
| Tekniske minimumsanbefalinger til CT-skanning for, at HUtom værdier kan udmåles og binyre beskrives korrekt · Tomskanning · Snit ≤ 3 mm · Aksiale og koronale rekonstruktioner · Rørspænding = 120 kVp · Strømstyrke ≥ 50-60 mAs |
Udvaskning kan bestemmes ved skanning med kontrast. Mulige maligne tumorer er karakteriseret ved højere kontrastretention, dvs. mindre udvaskning. Data vedrørende udvasknings-CT er dog begrænsede og anvendeligheden er omdiskuteret.
I aktuelle retningslinje er benyttet værdier for skanning 1 og 15 min efter intravenøs kontrast indgift.
Ved HUtom ≤ 10 giver CT med udvaskning ikke yderligere oplysninger.
30 % af benigne adenomer er lipidfattige med HUtom > 10. I disse tilfælde vil beregning af udvaskning øge sensitiviteten af undersøgelsen mens specificiteten falder.
Udvaskningen beregnes som en relativ eller absolut ratio, hvor høje ratioer ses ved benigne forandringer.
Relativ udvaskningsratio = (HU1 min. – HU15 min.) / (HU1 min.)* 100
Absolut udvaskningsratio = (HU1 min. – HU15 min.) / (HU1 min. – HU tom) * 100
| Karakteristika for benign forandring: · HUtom ≤10 foreneligt med fedtvæv (sensitivitet 71 % og specificitet 98 %) · Relativ udvaskning > 40 % (sensitivitet 96 % og specificitet 100 %) · Absolut udvaskning > 60 % (sensitivitet 86-88 % og specificitet 92-96 %) · Manglende vækst over 2 år trods HUtom>10. Karakteristika for malignitetssuspekt forandring: · HUtom>10 · Relativ udvaskning < 40% · Absolut udvaskning på < 60 % · Størrelse >4 cm og HUtom>10 uafhængigt af udvaskning · Irregulær form, heterogen densitet, uskarp afgrænsning, invasion · Vækst > 5 mm/år |
MR synes at have ligeværdig diagnostisk rigtighed som CT, men er ikke valideret i samme omfang.
c. Ultralydsvejledt biopsi
Som udgangspunkt skal man ikke foretage biopsi af en binyretumor. Ved mistanke om metastaser eller infektion kan biopsi dog komme på tale. Biopsi kan ikke benyttes til at afgøre om en adrenokortikal tumor er benign eller malign. Fæokromocytom skal udelukkes før biopsi.
d. FDG-PET/CT skanning
Benyttes ikke i initiale udredning. Sensitivitet 91% [95% CI (88–94%)] og specificitet 91
[95% CI (87–93%)] i metanalyse 14,15 men større studier på performance i en binyreincidentalom population mangler.
Risiko for falsk positive er rapporteret i ældre studier.
Risiko for falsk negative ved små metastaser med signifikante nekroser.
Se iø. nedenfor omkring patienter med cancersygdom.
Specielle problemstillinger
Bilaterale incidentalomer
Adrenale incidentalomer er hyppigt forekommende, 10-15 % af patienter har bilaterale incidentalomer.
Som hovedregel foregår hormonel og billeddiagnostisk udredning af patienter med bilaterale incidentalomer på samme måde som unilateralt incidentalom.
Følgende diagnoser ses hyppigere hos patienter med bilaterale binyreincidentalomer:
- Fæokromocytom
- Bilateral makronodulær adrenal hyperplasi
- Kongenit adrenal hyperplasi
- ACTH afhængig Cushing
- Lymfom, infektion, blødning,
- Metastaser
- Granulomatøs sygdom
Hos patienter med bilaterale incidentalomer overvejes måling af 17-OH progesteron (21-hydroxylase mangel) samt risiko for binyrebarkinsufficiens.
Patienter med kendt malign sygdom, IKKE incidentalom
Mange patienter med malign sygdom vil i forbindelse med billeddiagnostik få påvist en binyretumor.
- Binyretumor med godartet udseende (primært HUtom ≤ 10): Samme biokemiske og billeddiagnostiske udredning og opfølgning som hos patienter uden kendt cancersygdom under hensyntagen til cancersygdommens sværhedsgrad.
- Binyretumor med malignt/uafklaret udseende (typisk HUtom >10):
Differentialdiagnose til metastase vil være fæokromocytom.
Kirurgisk indgreb inkl biopsi bør afvente screening for fæokromocytom.
Normal kontrastudvaskning afkræfter ikke sikkert mistanke om malignitet specielt ikke ved personer med kendt hepatocellulært carcinom eller renal celle cancer, hvor binyremetastaser ofte vil have normal udvaskning 16.
OBS: Ved bilaterale metastaser skal overvejes test for binyrebark insufficiens.
Follow-up (se figur 1)
a) Operation
- Generelle indikationer for operation:
- Hormon-overproduktion (dog uafklaret ved mild autonom kortisol sekretion)
- Tumor >4 cm og HUtom >10 uafhængigt af washout
- CT skanning giver mistanke om mulig malignitet (HUtom >10 og lav washout). Ved mindre tumores (1-2 cm) kan observation overvejes.
- Vækst af tumor > 5 mm/år (se under “Observation uden operation”)
- Da binyreincidentalomer er sjældne hos yngre patienter (< 40 år), er der generelt større operationsindikation hos denne gruppe.
- Ved godartede tumorer > 6 cm kan adrenalektomi overvejes under hensyntagen til alder, tidligere abdominale operationer og anden komorbiditet. Med tumor størrelse stiger risikoen for konvertering til åben operation, samt andre komplikationer.
- Før adrenalektomi af malignitetssuspekt tumor udføres CT af thorax og abdomen eller FDG-PET/CT for at udelukke at binyretumoren er en metastase fra en uerkendt ekstra-adrenal cancer.
b) Observation uden operation
Opfølgende billeddiagnostik 17-19:
OBS vækstpotentiale, dvs. om der er mistanke om cancer.
Pga. måleusikkerhed skønnes vækstpotentiale at være vækst > 20% (dog minimum 5 mm). Benigne forandringer vokser < 3 mm/år.
Hvis der er tvivl om vækst anbefales fornyet skanning efter ca. 6 mdr.
Hos yngre patienter (< 40 år) med 2-4 cm tumor uden umiddelbar operationsindikation kan CT kontrol tilbydes.
Fedtfattige tumores (≤ 4 cm, HUtom >10, absolut udvaskning >60 % og relativ udvaskning > 40 %) er der ikke så stor viden om og kan tilbydes en kontrolscanning efter 6-12 måneder.
Skanningsmodaliteter ved kontrol:
CT skanning uden kontrast (evt lavdosis CT)
MR skanning kan benyttes for at minimere stråledosis.
Tilstande som ikke kræver yderligere billeddiagnostisk opfølgning:
- Cyster
- Adenomer (HUtom ≤10) hos patienter >40 år
- Myelolipomer (med karakteristisk udseende samt HU < -10)
c) Opfølgende hormonanalyse
Ingen hvis baseline hormonanalyser er normale (inklusiv plasma kortisol < 50 nmol/l efter over night dexametason suppressionstest).
Supplerende
Patientinformation til inspiration her.
Referencer
- Mayo-Smith WW, Song JH, Boland GL, et al. Management of Incidental Adrenal Masses: A White Paper of the ACR Incidental Findings Committee. J Am Coll Radiol 2017;14(8):1038-1044. DOI: 10.1016/j.jacr.2017.05.001.
- Barzon L, Sonino N, Fallo F, Palu G, Boscaro M. Prevalence and natural history of adrenal incidentalomas. European journal of endocrinology / European Federation of Endocrine Societies 2003;149(4):273-85. DOI: 10.1530/eje.0.1490273.
- Ebbehoj A, Li D, Kaur RJ, et al. Epidemiology of adrenal tumours in Olmsted County, Minnesota, USA: a population-based cohort study. Lancet Diabetes Endocrinol 2020;8(11):894-902. DOI: 10.1016/S2213-8587(20)30314-4.
- Reimondo G, Castellano E, Grosso M, et al. Adrenal Incidentalomas are Tied to Increased Risk of Diabetes: Findings from a Prospective Study. The Journal of clinical endocrinology and metabolism 2020;105(4). DOI: 10.1210/clinem/dgz284.
- Song JH, Chaudhry FS, Mayo-Smith WW. The incidental adrenal mass on CT: prevalence of adrenal disease in 1,049 consecutive adrenal masses in patients with no known malignancy. AJR American journal of roentgenology 2008;190(5):1163-8. DOI: 10.2214/AJR.07.2799.
- Hammarstedt L, Muth A, Wangberg B, et al. Adrenal lesion frequency: A prospective, cross-sectional CT study in a defined region, including systematic re-evaluation. Acta Radiol 2010;51(10):1149-56. DOI: 10.3109/02841851.2010.516016.
- Iniguez-Ariza NM, Kohlenberg JD, Delivanis DA, et al. Clinical, Biochemical, and Radiological Characteristics of a Single-Center Retrospective Cohort of 705 Large Adrenal Tumors. Mayo Clin Proc Innov Qual Outcomes 2018;2(1):30-39. DOI: 10.1016/j.mayocpiqo.2017.11.002.
- Mantero F, Terzolo M, Arnaldi G, et al. A survey on adrenal incidentaloma in Italy. Study Group on Adrenal Tumors of the Italian Society of Endocrinology. The Journal of clinical endocrinology and metabolism 2000;85(2):637-44. DOI: 10.1210/jcem.85.2.6372.
- Fassnacht M, Arlt W, Bancos I, et al. Management of adrenal incidentalomas: European Society of Endocrinology Clinical Practice Guideline in collaboration with the European Network for the Study of Adrenal Tumors. European journal of endocrinology / European Federation of Endocrine Societies 2016;175(2):G1-G34. DOI: 10.1530/EJE-16-0467.
- Buitenwerf E, Korteweg T, Visser A, et al. Unenhanced CT imaging is highly sensitive to exclude pheochromocytoma: a multicenter study. European journal of endocrinology / European Federation of Endocrine Societies 2018;178(5):431-437. DOI: 10.1530/EJE-18-0006.
- Canu L, Van Hemert JAW, Kerstens M, et al. CT characteristics of pheochromocytoma – Relevance for the evaluation of adrenal incidentaloma. The Journal of clinical endocrinology and metabolism 2018;104(2):312-318. DOI: 10.1210/jc.2018-01532.
- Kjellbom A, Lindgren O, Puvaneswaralingam S, Londahl M, Olsen H. Association Between Mortality and Levels of Autonomous Cortisol Secretion by Adrenal Incidentalomas : A Cohort Study. Annals of internal medicine 2021;174(8):1041-1049. DOI: 10.7326/M20-7946.
- Caoili EM, Korobkin M, Francis IR, et al. Adrenal masses: characterization with combined unenhanced and delayed enhanced CT. Radiology 2002;222(3):629-33. DOI: 10.1148/radiol.2223010766.
- Kim SJ, Lee SW, Pak K, Kim IJ, Kim K. Diagnostic accuracy of (18)F-FDG PET or PET/CT for the characterization of adrenal masses: a systematic review and meta-analysis. Br J Radiol 2018;91(1086):20170520. DOI: 10.1259/bjr.20170520.
- Bancos I, Prete A. Approach to the patient with adrenal incidentaloma. The Journal of clinical endocrinology and metabolism 2021. DOI: 10.1210/clinem/dgab512.
- Choi YA, Kim CK, Park BK, Kim B. Evaluation of adrenal metastases from renal cell carcinoma and hepatocellular carcinoma: use of delayed contrast-enhanced CT. Radiology 2013;266(2):514-20. DOI: 10.1148/radiol.12120110.
- Elhassan YS, Alahdab F, Prete A, et al. Natural History of Adrenal Incidentalomas With and Without Mild Autonomous Cortisol Excess: A Systematic Review and Meta-analysis. Annals of internal medicine 2019;171(2):107-116. DOI: 10.7326/M18-3630.
- Corwin MT, Navarro SM, Malik DG, et al. Differences in Growth Rate on CT of Adrenal Adenomas and Malignant Adrenal Nodules. AJR American journal of roentgenology 2019;213(3):632-636. DOI: 10.2214/AJR.19.21342.
- Bernini GP, Moretti A, Oriandini C, Bardini M, Taurino C, Salvetti A. Long-term morphological and hormonal follow-up in a single unit on 115 patients with adrenal incidentalomas. British journal of cancer 2005;92(6):1104-9. DOI: 10.1038/sj.bjc.6602459.
Marianne Andersen, Claus Larsen Feltoft, Dorte Glintborg, Jørgen Hangaard, Klavs Würgler Hansen, Per Holt (urolog), Claus Jensen (radiolog), Per Løgstrup Poulsen, Åse Krogh Rasmussen, Lars Rolighed (kirurg), Bieke Schrijvers, Mette Sonne, Christian Trolle (Tovholder)
Tovholder
Arbejdsgruppen, øvrige
Per Holt (urolog)
Andreas Ladefoged Ebbehøj (Ph.d.-studerende)
Claus Jensen (radiolog)
Per Løgstrup Poulsen
Åse Krogh Rasmussen
Lars Rolighed (kirurg)
Bieke Schrijvers
Mette Sonne
Revideret: Oktober 2021
Næste revision: Oktober 2024