Hvad omfatter denne NBV
I den kliniske hverdag er der så mange fælles problemstillinger vedrørende primær, sekundær og tertiær binyrebarkinsufficiens, hvorfor disse områder inddrages i samme NBV. Specifikt omtales nedenstående facetter:
- Primær binyrebarkinsufficiens, inklusiv Autoimmun Polyendokrin Syndrom (APS), Adrenogenital Syndrom (AGS) og Adrenoleukodystrofi (ALD)
- Sekundær og tertiær binyrebarkinsufficiens, inklusiv binyrebarkinsufficiens som følge af systemisk behandling med glukokortikoide lægemidler og opioider
- Diagnostik og behandling under graviditet
- Diagnostisk og behandling under akut og kritisk sygdom
- Lægemiddel interaktion
- Assay problemer
Hvad omfatter denne NBV ikke
- Binyrebarkinsufficiens hos børn
Diagnosekoder (ICD)
- Primær: DE271, DE271A
- Sekundær: DE230, DE230B, DE233, DE236
- Anden og UNS: DE274, DE274A / B / C
- Addison krise DE272
- Lægemiddelinduceret: DE273
- Autoimmun Polyendokrin Syndrom: DE310, DE310A
- Adrenoleukodystrofi: DE713A
- Adrenogenital Syndrom: DE250, DE250A/B/C/D, DE258, DE258A, DE259
Forkortelser
ACTH: Adreno-kortikotropt hormon
AGS: Adrenogenital syndrom
ALD: Adrenoleukodystrofi
APS: Autoimmunt polyendokrint syndrom
BMD: Bone mineral density
CBG: Cortisol-bindende globulin
CRH: Corticotropin-releasing hormon
DHEA: Dehydroepiandrosterone
DHEAS: Dehydroepiandrosteron-sulfat
DXA: Dual-energy X-ray absorptiometry
HPA: Hypothalamus-hypofyse-binyreaksen
SMR: Standardiseret mortalitetsrate
TSH: Thyroidea stimulerende hormon
VLCFA: Very long chain fatty acids (meget langkædede fedtsyrer)
Definition
Tilstand hvor binyrernes produktion af binyrebarkhormonerne kortisol og aldosteron ikke dækker kroppens behov for disse.
Tilstanden opdeles afhængig af, hvor defekten er lokaliseret, i primær (binyrer), sekundær (hypofyse) og tertiær (hypothalamus) binyrebarkinsufficiens. Endvidere skelnes mellem akut og kronisk binyrebarkinsufficiens.
Forekomst
- Primær binyrebarkinsufficiens(1-3):
- Incidens (kaukasiere): skønnet 4,4 – 6,0 pr million/år
- Prævalens: skønnet 93 – 220 pr million
- Sekundær/tertiær binyrebarkinsufficiens (eksklusive medicinsk induceret):
- Incidens: ukendt
- Prævalens: skønnet 120 – 280 pr. million (4)
- Glukokortikoid induceret binyrebarkinsufficiens:
- Op mod halvdelen af patienter behandlet med systemisk glukokortikoid udvikler binyrebarkinsufficiens, og nogle patienter forbliver insufficiente flere år efter ophør af glukokortikoid behandlingen, afsnit herom (5, 6)
- Opioid induceret binyrebarkinsufficiens:
- Det skønnes at 9-15% af patienter med et kronisk opioidforbrug har tertiær binyrebarkinsufficiens. Det er observeret i morfin ækvivalente døgn doser ≥ 20 mg, og risikoen stiger med den kumulative dosis, afsnit herom.
Ætiologi
Primær binyrebarkinsufficiens (se Tabel 1):
- Medfødt: Defekt i steroidsyntesen
- Erhvervet: Hyppigst autoimmun adrenalitis (Mb. Addison)
Tabel 1. Årsager til primær binyrebarkinsufficiens
| Autoimmun | Isoleret autoimmun adrenalitis (ca. 39 %) APS Type I (ca. 14 %), II (ca. 44 %) og IV (ca. 3 %) |
| Infektiøs* | Tuberkulose HIV Svampeinfektioner Syphilis Trypanosomiasis |
| Blødning | DIC ved sepsis (fx meningokokker) Primært antiphospholipid syndrome |
| Metastaser | Især fra C. pulmonis, C. ventriculi, C. mammae og C. coli |
| Infiltrative | Primært adrenalt lymfom Amyloidose Haemochromatose |
| Kirurgi | Bilateral adrenalektomi |
| Medicin | Hæmning af enzymer involveret i steroidogenese Metyrapon, Mitotane, Osilodrostat, Ketoconazole, Fluconazol, Itreconazol Etomidate, Aminogluthethimid, Trilostan Øget kortisol metabolisme Phenobarbital, Phenytoin, Rifampicin, Mitotane Adrenolytisk Mitotane Blødning Antikoagulantia Inflammatorisk Immun-onkologisk behandling med checkpoint-inhibitorer (Nivolumab®, Ipilimumab®, Pembrolizumab® m.fl.)** |
| Genetiske | Adrenogenital syndrom (AGS) Adrenoleukodystrofi /adrenomyeloneuropati |
**Kan medføre primær og sekundær binyrebarkinsufficiens, hyppigst sekundær insufficiens *Hyppig årsag i udviklingslande
Sekundær/tertiær binyrebarkinsufficiens (se Tabel 2):
Hyppigst forekommende årsager er hypofyse- eller hypofysenære tumorer, samt evt. behandling heraf (fx. kirurgi eller strålebehandling), samt medikamentelt induceret insufficiens efter brug af fx glukokortikoider.
Tabel 2. Årsager til sekundær/tertiær binyrebarkinsufficiens
| Genetiske | Defekt af transskriptions faktorer Dysplasia/aplasia |
| Hypothalamisk/-pituitær sygdom | Tumorer: Hypofyse adenomer, secernerende eller non- secernerende Kraniopharyngiomer, meningiomer, germinomer, cyster, gliomer, hamartomer Infiltrative/Inflammatoriske sygdomme: Autoimmun hypophysitis, sarcoidose, amyloidose, histiocytosis X, metastaser Infektioner: Tuberkulose, svampe, toxoplasmose, pneumocystis carinii, meningitis/encephalitis Vaskulære sygdomme: Pituitær apoplexi, Sheehan’s syndrom, subarachnoidal blødning |
| Iatrogen | Hypothalamisk-pituitær skade påført ved operation/strålebehandling Medicinsk induceret, fx. glukokotikoider, opioider, immun checkpoint inhibitorer, somatostatin analoger, interferon |
| Andre | Empty sella, hovedtraumer, idiopatisk |
Symptomer og kliniske fund
Mange af symptomerne på binyrebarkinsufficiens er uspecifikke og dermed medvirkende årsag til forsinkelse af diagnose og behandling. Symptomer og fund afhænger af hastigheden og graden af tab af binyrebarkfunktionen, samt hvorvidt både glukokortikoid- og mineralokortikoid sekretionen er påvirkede (Tabel 3). Se endv. afsnit om akut binyrebarkinsufficiens.
Primær binyrebarkinsufficiens: Svigtet sker oftest langsomt (over måneder og år) og er ofte uerkendt indtil anden akut sygdom eller stress udløser akut binyrebarkinsufficiens (= Addison krise). Sygdommen præsenterer sig oftest med symptomer i form af nedsat appetit, vægttab, kvalme, træthed, mavesmerter og muskel/led smerter. Karakteristisk ses hyperpigmentering af hud og slimhinder. Ca. 50% af patienter med autoimmun primær binyrebarkinsufficiens har symptomer relaterede til en anden autoimmunlidelse (f.eks. autoimmun thyroiditis, type 1 DM, perniciøs anæmi, præmatur ovarieinsufficiens o. a.).
Sekundær og tertiær binyrebarkinsufficiens: adskiller sig fra primær binyrebarkinsufficiens ved normal mineralokortikoid funktion, hvorfor der ses færre elektrolytforstyrrelser og mindre grad af dehydrering. Desuden fravær af hyperpigmentering. Mangel på kortisol svækker den renale udskillelse af frit vand og kan herved sløre symptomer på evt. diabetes insipidus.
Tabel 3. Oversigt over symptomer og fund ved hhv. primær og sekundær/tertiær binyrebarkinsufficiens, ordnet efter forekomsten: + + + høj, + + moderat, + lav, +/- sjældent, – ingen. Modificeret efter Williams textbook of Endocrinology, 12th ed.
| Binyrebarkinsufficiens | Primær | Sekundær og tertiær |
| Symptomer Træthed/manglende energi/asteni Nedsat appetit/anorexi Kvalme/opkastninger Mavesmerter Obstipation/diarré Salthunger Ortostatisk svimmelhed Muskel- og ledsmerter Nedsat libido Amenoré Depression Personlighedsforstyrrelser | + + + + + + + + + + + + + / + + + + + + + + | + + + + + + + + + – – + + + + + + |
| Kliniske fund Vægttab Hyperpigmentering (hud, slimhinder) Hypotension Dehydrering Vitiligo Tab af axil- og pubesbehåring (kvinder) | + + + + + + + + + + + + + | + + – + – – + |
| Biokemiske fund Hyponatræmi Hyperkaliæmi Forhøjet ACTH Forhøjet se-kreatinin/karbamid Forhøjet TSH (mild) Anæmi Neutropeni, relativ lymfocytose Eosinofili Hyperkalkæmi (mild) Hypoglykæmi | + + + + + +++ + + + + + + + + + + / – + (især hos børn) | + + – – – – + + + + + + / – + + (ved GH mangel) |
Diagnostik og udredning
Generelt
Basal kortisol:
Basal morgen P-kortisol < 100 nmol/l tyder på binyrebarkinsufficiens, mens et tilfældigt målt p-kortisol på > 420 nmol/l er forenelig med normal binyrebarkfunktion, hos patienter som ikke får perorale østrogener, er gravide eller behandles med steroider som kan interferere med analysen. Evidensen for anvendelse af basal kortisol målinger er imidlertid lav, hvorfor diagnosen binyrebarkinsufficiens oftest stilles ved hjælp af en stimulationstest.
Stimulations-tests:
I Danmark anvendes 2 tests
- Synacthen® test (ACTH-test): Den hyppigst anvendte test, og førstevalg. Testen anvender syntetisk ACTH, der stimulerer binyrernes kortisol respons. Lavdosis Synacthen® test, hvor der anvendes 1 µg frem for 250 µg Synacthen®, anbefales ikke i daglig klinisk praksis
- Insulin tolerance testen anses for guld standarden, til diagnostik af sekundær/tertiær binyrebarkinsufficiens. For beskrivelse: se NBV hypofyseinsufficiens
Internationalt anvendes endvidere glucagon-, metyrapon- og CRH tests.
Synacthen® test-procedure:
Kontraindikation og forsigtighedsregler:
- Kendt overfølsomhed i forbindelse med tidligere Synacthen® test
- Astma, andre IgE-medierede hyperimmune tilstande med øget risiko for hypersensitivitets reaktioner udgør ikke kontraindikation, men vanligt anafylaksi-beredskab skal være tilgængeligt
- Synacthen® testen kan foretages under både graviditet og på ammende kvinder
Forberedelse:
- Hydrokortison skal være pauseret mindst 12 timer, helst 24 timer før testen, prednisolon helst 48 timer før. Ved manglende pausering af hydrokortison/prednisolon risikeres falsk forhøjede P-kortisol målinger i assays med stor krydsreaktivitet
- Perorale østrogen-holdige præparater pauseres 2 – 3 måneder før testen. Udføres testen uden forudgående østrogenpause er kun insufficient test respons sikkert diagnostisk
Udførelse:
Blodprøve til bestemmelse af P-kortisol (og P-ACTH) udtages til tiden 0 min, hvorefter der gives 250µg Synacthen® i.v., over ca. 1 min. Blodprøve til bestemmelse af P-kortisol udtages igen efter 30 min.
Tolkning af test:
- 30 min P-kortisol < cut-off grænsen understøtter diagnosen binyrebarkinsufficiens
- Hidtil har en cut-off omkring 500 nmol/l været anvendt, men ved anvendelse af nye, mere præcise immunoassays og massespektrometri (LC-MS/MS) bør cut-off værdien reduceres til omkring 420 nmol/l (7, 8) (se nedenfor)
- Værdier omkring cut-off grænsen ± 10 % udgør en gråzone og her vil stillingtagen til evt. substitutionsbehandling afhænge af klinik. Gentagelse af undersøgelsen vil ofte være af værdi
- 0-minutter værdien anvendes ikke diagnostisk, ej heller stigningen i P-kortisol fra 0 min. til 30 min
- P-kortisol afspejler den totale koncentration af kortisol i plasma. Kortisol findes langt overvejende bundet til kortisol bindende globulin (CBG). Koncentrationen af CBG stiger betydeligt under graviditet og brug af peroralt østrogen, hvorfor Synacthen stimuleret 30 min. P-kortisol over cut-off grænsen ikke kan tolkes som udtryk for en normal binyrebarkfunktion. Ved et insufficient respons mistænkes binyrebarkinsufficiens og substitutionsterapi startes. For at opnå et retvisende svar bør Synacthen® testen gentages efter 2 – 3 måneders østrogen-pause. Estimater af ”frit kortisol” (fx kortisol/CBG-ratio) har vist sig uanvendelige til etablering af cut-off hos kvinder i peroral østrogen behandling(9). For tolkning af Synacthen® test under graviditet henvises til særskilt afsnit om ”Graviditet hos patienter med binyrebarkinsufficiens”
- CBG ses reduceret ved nefrotisk syndrom, lever cirrhose og malnutrition. Genetisk defekt (sjældent)
- Anvendelse af spyt-kortisol/kortison som mål for frit kortisol er ikke valideret, og er for nuværende ikke en accepteret test til vurdering af binyrebarkinsufficiens
- Værdien af plasma kortisol til diagnostik af binyrebarkinsufficiens hos den akut syge er begrænset og der foreligger ingen diagnostisk cut-off. Hos den akut syge er der derfor primært tale om en klinisk diagnose, der siden må verificeres ved en stimulationstest. En lav koncentration af basal kortisol vil hos den akut syge dog understøtte mistanken om binyrebarkhormonmangel
- I Danmark anvendes aktuelt 5 forskellige immunkemiske rutineanalysemetoder ud over LC-MS/MS (massespektrometri) – se appendiks II
- Ved alle immunkemiske metoder kan krydsreaktivitet med andre steroider og metabolitter forekomme, hvilket kan give anledning til falsk forhøjede værdier og påvirke cut-off værdien. Når det kliniske billede ikke stemmer med den fundne kortisol koncentration, anbefales det at konferere med den klinisk biokemiske afdeling, og verificere analysesvaret med en LC-MS/MS metode (aktuelt Vejle og Slagelse)
- Medio 2018 undersøgte Dansk Institut for ekstern kvalitetssikring for laboratorier i Sundhedssektoren (DEKS) om det er muligt at indføre en fælles cut-off for 30 min P-kortisol i Danmark. Alle laboratorier i DK som foretager analyse af P-kortisol deltog. Analyseniveauerne blev bedømt ud fra referenceværdier fremkommet ved bestemmelse på 3 laboratorier med LC-MS/MS (2 danske og 1 engelsk) over for certificeret referencemateriale samt 9 serumprøver indsamlet af DEKS. I serumprøver uden krydsreaktivitet måler rutineinstrumenterne Abbot, Roche, Siemens Immulite i samme niveau som LC-MS/MS. Undersøgelsen tyder således på at der kan anvendes samme cut-off værdi i hele landet, når blot hvert laboratorium korrigerer bias i forhold til certificeret referencemateriale. På baggrund af denne undersøgelse samt retrospektive data, foreslås en cut-off værdi på 420 nmol/L (7, 10). Præsentation med link til EQA rapporten: http://deks.dk/wp-content/uploads/2019/09/9.4-MP.pdf.
Primær binyrebarkinsufficiens
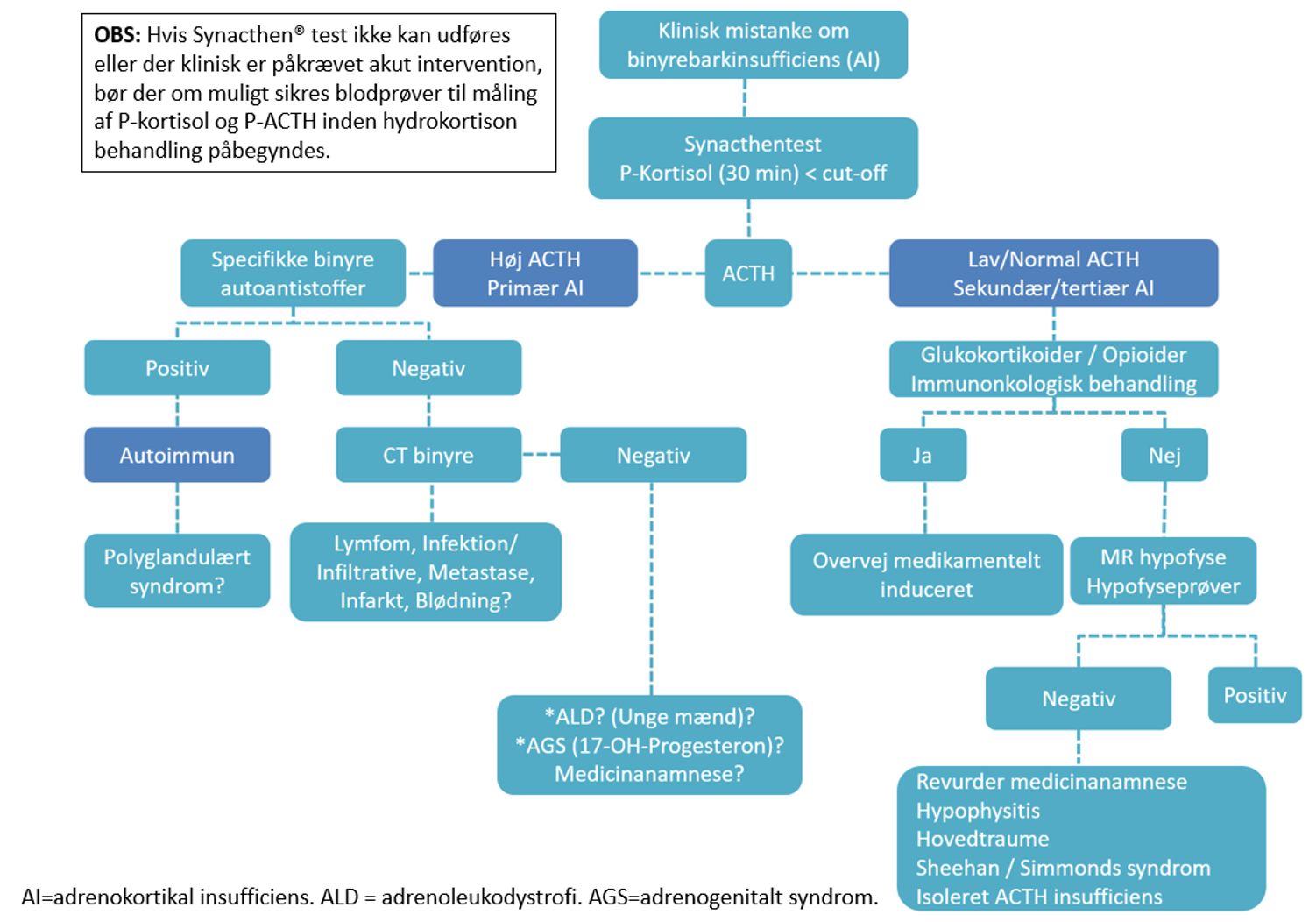
Diagnostik og udredning af årsag til primær binyrebarkinsufficiens – se flowchart nedenfor.
- Glukokortikoid insufficiens: Synacthen® test med insufficient kortisol respons kombineret med p-ACTH > 2 x øvre normal grænse
- Mineralokortikoid insufficiens: Lav aldosteron, høj renin. Ofte hyponatriæmi samt hyperkaliæmi
ALTID
- Binyrebarkantistof (kan være negative ved autoimmun adrenalitis og udelukker ikke autoimmun ætiologi).
OVERVEJ
- CT-scanning af binyrer udføres ved negative binyrebarkantistoffer, for at afklare ætiologi (metastaser (lunge, bryst, ventrikel, colon og lymfom), tuberkulose, hæmorhagi, o.a.).
- Very Long Chain Fatty Acids (VLCFA) og/eller ABCD 1 genanalyse hos unge mænd uden positive binyrebark antistoffer (se appendix; X-ALD).
- 17-OH progesteron hvis partiel 21-hydroxylase defekt /late-onset AGS mistænkes (se appendix; AGS).
- Deoxycorticosteron (DOC) hvis 11-hydroxylase defekt mistænkes (oftest hypertension, lav/normal kalium, lav/normal renin pga. DOC’s mineralokortikoid effekt)
- Iatrogen årsag (ketoconazol, rifampicin, fenytoin, barbiturater, etomidat, metyrapon, mitotane, immunonkologisk behandling med Checkpoint-inhibitorer)
- HIV / AIDS
- Fokus på anden autoimmunitet hvis autoimmun binyrebarkinsufficiens er fastslået (se Tabel 8)
RARITETER
- Kongenit adrenal hypoplasi (DAX og SF-1 mutationer)
- Familiær glukokortikoid mangel (ACTH receptor mutationer inkl. Allgrove / Triple A Syndrome: Adrenal insufficiency, Achalasi, og Alacrimi)
- Familiær glukokortikoid resistens (glukokortikoid receptor defekter)
- StAR mutation (lipoid kongenit adrenal hyperplasi: defekt mitokondriel kolesterol transfer). Gonader også afficerede.
Flowchart: Udredning af binyrebarkinsufficiens.
Sekundær/tertiær binyrebarkinsufficiens
Diagnostik og udredning af årsag til sekundær/tertiær binyrebarkinsufficiens – se flowchart.
- Insufficient kortisol respons under en stimulationstest kombineret med lavt eller inappropriat normalt/let forhøjet p-ACTH
- Obs! Synacthen® test kan vise normal kortisol respons initialt efter debut af sekundær/tertiær binyrebarkinsufficiens (ex. efter hypofysekirurgi eller pituitær apopleksi), idet en akut opstået ACTH-mangel endnu ikke har medført atrofi af binyrebarken. Ved kort symptomvarighed eller indenfor 1-2 måneder efter hypofyseoperation udelukker en normal Synacthen® test således ikke sekundær eller tertiær binyrebarkinsufficiens
- Efter hypofysekirurgi anvendes på nogle centre basal morgen kortisol målt 1. eller 2. postoperative døgn til at selektere patienter der bør opstarte hydrokortison efter transsphenoidal hypofysekirurgi(11). Der foreligger imidlertid ikke en fast grænseværdi, og vurderingen må således bero på klinik og lokale forhold. I et nyligt dansk studie fandt man, at basal morgen spot kortisol under 300 nmol/L prædikterede binyrebarkinsufficiens 6 måneder efter transsphenoidal hypofysekirurgi med en sensitivitet og specificitet på hhv 100% og 81% (11, 12). Obs! Tolkning er ikke mulig såfremt patienten har fået peroperativ dexamethason.
Se endvidere afsnit om ’Glukokortikoid-induceret binyrebarkinsufficiens’, og ’Opioid-induceret binyrebarkinsufficiens’.
Behandling
Kronisk binyrebarkinsufficiens
Behandlingsmål:
- Forhindre komplikationer, specielt akut binyrebarkinsufficiens
- Sikre lavest mulig risiko for uhensigtsmæssige metaboliske og andre bivirkninger til den glukokortikoide og mineralokortikoide behandling
- Optimere livskvalitet og funktionsniveau, med lavest mulig dosis af hydrokortison under basale omstændigheder.
Generelt om behandlingen:
- Personer med normal binyrebarkfunktion producerer mellem 5 og 10 mg kortisol pr. m2 svarende til en oral substitutionsdosis på omkring 10 – 25 mg hydrokortison pr. dag i ustressede situationer (13, 14), hvilket stiger mangefold ifm. stress(15).
- Substituering af binyrebarkens hormonproduktion er oftest livslang, dog vil patienter med sekundær/tertiær binyrebarkinsufficiens potentielt kunne genvinde en normal kortisolproduktion. Sekundær binyrebarkinsufficiens udløst af checkpoint-inhibitorer anses for at være kronisk
- Trods forsøg på optimal substitutionsbehandling oplever mange patienter med binyrebarkinsufficiens nedsat funktionsniveau, forringet helbred og manglende overskud til fritidsinteresser og erhvervsarbejde på normale betingelser. Nogle patienter har behov for deltidsbeskæftigelse, fleksjob eller helbredsbetinget førtidspension.
Glukokortikoid substitution
For vejledende ækvipotente doser for glukokortikoider – se https://pro.medicin.dk/Laegemiddelgrupper/Grupper/171030
Hydrokortison® (20 mg, 10 mg, 2,5 mg)
Det anbefalede glukokortikoid. Naturligt glukokortikoid med relativ stærk mineralokortikoid virkning. Kort halveringstid (1½-2 timer). Enkelte foretrækker prednisolon i lav dosis 2,5 – 5 mg (syntetisk, svag mineralokortikoidvirkning, halveringstid 4-5 timer), men flere studier tyder på en øget forekomst af osteoporose ved anvendelse af syntetiske glukokortikoider. .
- Vedligeholdelsesdosis hos voksne er 10 – 25 (30) mg per døgn. Ca. 12 mg/m2 eller 0,3 mg/kg. F.eks. 180 cm, 80 kg = 2,0 m2: 24 mg hydrokortison/dag
- Dosis justeres individuelt, og målet er den lavest mulige dosis, som giver symptomfrihed, og som ikke medfører bivirkninger (for symptomer på over-/underbehandling – se tabel 7)
- Den daglige substitutionsdosis og fordeling er individuel
- Doseres således at den normale døgnvariation af kortisol forsøges efterlignet, dvs. højeste dosis om morgenen (første dosis tages så snart man vågner), lavere dosis til frokost og mindste dosis sidst på eftermiddagen. Eksempelvis
– 20 mg/dag: 10+5+5 mg eller 12½+5+2½ mg
– 25 mg/dag: 10+10+5 mg eller 15+7½+2½ mg - Nogle medikamenter øger metabolismen af kortisol, f.eks. Fenytoin, Barbiturater og Rifampicin. Undertiden er en fordobling af glukokortikoiddosis nødvendig
- Lakrids og specielt grapefrugt øger effekten af hydrokortison og kortison acetat, og bør undgås.
Kortisonacetat (5mg, 25 mg)
Enkelte patienter foretrækker det magistrelle præparat kortisonacetat. Kortisonacetat er et pro-hormon som i leveren omdannes til hydrokortison/kortisol.
- 25 mg kortisonacetat svarer til ca. 20 mg hydrokortison
Plenadren® (5mg, 20 mg)
Hydrokortison med modificeret frigivelse, hvor en del af dosis frigives umiddelbart og en del frigives langsommere.
- Indtages en gang dagligt om morgenen, mindst 30 min før morgenmåltid. Tabletterne skal synkes hele
- Dosis til voksne: vanligvis 10 – 20 (30) mg. Behandlingen indledes med en høj dosis. Når tilfredsstillende virkning er opnået, kan dosis evt. nedsættes
- Plenadren er betydelig dyrere end hydrokortison (omkring 40 gange), og det er endnu ikke dokumenteret at have en klinisk betydende bedre effekt end hydrokortison (se ’ Perspektiv – nye behandlingsmodaliteter’). Plenadren anses således ikke for at være standardbehandling.
Mineralokortikoid substitution
Fludrokortison, Florinef® (0,1 mg)
- Anvendes ved primær binyrebarkinsufficiens
- Doseres oftest én gang dagligt om morgenen
- Vanlig voksendosis er 0,05 – 0,2 mg (oftest 0,1 mg)
- Enkelte patienter har et minimalt behov og kan nøjes med en meget lille dosis på 0,05 – 0,1 mg få dage om ugen – evt. blot tilskud af bordsalt
- Behovet for fludrokortison er nøje relateret til indtag og tab af elektrolytter
- Dosis af fludrokortison bedømmes ud fra klinik og paraklinik
- Paraklinisk evalueres dosis ved måling af plasmaniveau af natrium, kalium og renin. P-renin koncentrationen bør ligge i øvre del af referenceområdet eller lidt over for at undgå overdosering
- Kliniske og biokemiske tegn på underdosering: Salthunger, træthed, svimmelhed, ortostatisme, lavt blodtryk, kvalme, hyponatriæmi, hyperkaliæmi, højt plasma-renin.
- Kliniske og biokemiske tegn på overdosering: Hypertension, ødemtendens. hovedpine, forhøjet BT, ledstivhed/ømhed, hypokaliæmi, lavt-normal p-renin.
- Diuretika og andre medikamenter, som påvirker blodtryk og elektrolytter kræver justering af fludrokortison dosis.
- Dosis skal ikke øges ifm. stress.
- Lille dosisøgning ofte nødvendig ved større svedsekretion (hårdt fysisk arbejde eller varmt og fugtigt klima).
- Hos patienter med essentiel hypertension, bør dosis af fludrokortison søges reduceret. Ved behov for antihypertensiva er første valg en ACE-hæmmer eller en Angiotensin-II receptorantagonist. Anden valg er en calciumantagonist. Loop-diuretika anvendes med forsigtighed og mineralokortikoid receptorantagonist er kontraindiceret(16).
Binyreandrogen substitution
Binyreandrogener (DHEA og DHEAS) er ikke indregistreret i Danmark. Evidensen for substitution med DHEA eller DHEAS er meget begrænset, og har aktuelt ingen dokumenteret plads i behandlingen(17). Mangel på binyreandrogener har måske betydning for livskvalitet og knoglemineralisering, men større studier har givet divergerende resultater. Flere steder i udlandet forsøges eksperimentel behandling med DHEA 10 – 50 mg/dag, under kontrol af serum DHEA, velbefindende, livskvalitet og bivirkninger. Bivirkninger af androgen karakter kan ses, med bl.a. øget svedlugt og hirsutisme.
Ikke medicinsk behandling – se ’Patientuddannelse’
Stressberedskab
Ved interkurrent sygdom eller stress opstår et øget behov for glukokortikoid.
Patienten informeres om behov for øget dosis af hydrokortison i forbindelse med større belastning, såvel psykisk som fysisk stress. For eksempler – se tabel 4. Tabellen må betragtes som vejledende og skal tilpasses den enkelte patient og den konkrete situation. Dels foreligger der ikke evidensbaserede retningslinjer for stressdoser, og dels er der forskel i patienters sværhedsgrad af binyrebarkinsufficiens, og påvirkningen af psykisk stress og patientens øvrige helbredstilstand.
Patienter må tilrådes lav tærskel for at søge sundhedsfaglig vejledning ved tvivl om dosisøgning.
Når interkurrent sygdom er overstået, nedtrappes til normal dosis over få dage.
| Tabel 4. Eksempler på dosisøgning ifm. sygdom og stress. OBS Dosisforslag i skemaet er vejledende og skal tilpasses den enkelte patient og den konkrete situation. | |
| Eksempler på sygdom og stres | Justering af hydrokortison dosis |
| MILD STRESS For eksempel tandlægeskræk, jobsamtale, travlhed på job eller vanlig motion | Kræver normalt ikke dosisøgning, medmindre patienten har erfaring med at det er nødvendigt i disse situationer. I så fald tages ekstra 5-10 mg hydrokortison lige inden |
| MILD SYGDOM Lette tegn på sygdom (f.eks. forkølelse) og temperatur under 38 °C | Kræver normalt ikke dosisøgning, medmindre patienten har erfaring med at det er nødvendigt i disse situationer. I så fald tages ekstra 5-10 mg hydrokortison dagligt, gerne fordelt over døgnet, i kort periode |
| MODERAT STRESS Hård motion, f.eks. motion af mere end 2 timers varighed/gang (svømning, løb, cykling) | Vil ofte kræve ekstra hydrokortison, fx 5-10 mg ekstra 1 time før motion og 5-10 mg ekstra ved næste dosering |
| Tandlæge indgreb (fraset alm. tandrensning) | Vil ofte kræve ekstra 5-10 mg hydrokortsion inden indgrebet. |
| Trafikuheld eller anden legemsbeskadigelse | Patienter kan generelt tilrådes at tage 20 mg hydrokortison ekstra med det samme og søge lægehjælp for videre vejledning/behandling |
| Svær psykisk belastning som dødsfald i familien eller traumatisk oplevelse. | Vil ofte kræve fordobling af hydrokortisondosis initialt, fx de første dage |
| MODERAT SYGDOM Tegn på sygdom (f.eks. hoste eller ondt i halsen) og temperatur mellem 38 og 39 °C Kortvarigt opkast eller diarré | Fordobling af hydrokortisondosis |
| Temperatur over 39°C | Tredobling af hydrokortisondosis OBS behov for lægelig vurdering af patientens tilstand. |
| SVÆR SYGDOM ELLER STRESS Vedvarende opkastninger eller diare Akut binyrebarkinsufficiens (Addison krise), hvor symptomerne er vedvarende kvalme og opkastninger, appetitløshed, svimmelhed, udtalt træthed, dehydrering | Patienten skal indlægges og straks i behandling med i.v. hydrokortison (Solu Cortef®) – se afsnittet om akut binyrebarkinsufficiens |
| Enhver akut indlæggelse uanset årsag | Øget dosis hydrokortison som tablet eller i.v. (Solu-Cortef ®) – se afsnittet om akut binyrebarkinsufficiens |
Specielle terapeutiske situationer
Akut binyrebarkinsufficiens (Addison krise)
Akut livstruende tilstand, som kræver omgående behandling. Behandlingen må undertiden påbegyndes alene på klinisk mistanke. Manglende eller forsinket behandling kan resultere i dødeligt udfald.
Forekomst
Incidens: 6-7 kriser pr. 100 patient år
Over 40 % af patienter med binyrebarkinsufficiens har reporteret mindst et tilfælde af Addison krise. Forekommer specielt hos yngre, samt hos personer med høj komorbiditet. Ses hyppigst hos patienter med primær binyrebarksinsufficiens, da patienter med sekundær binyrebarkinsufficiens i højere grad kan have en delvist bevaret egenproduktion af kortisol, samt bevaret mineralokortikoid produktion (18-20).
Ætiologi
De hyppigste udløsende faktorer er gastroenterit og anden infektion med feber (45% af tilfælde), men akut binyrebarkinsufficiens kan også udløses af andre stresssituationer, såsom kirurgisk indgreb, ophør af substitutionsbehandling, manglende dosisøgning af hydrokortison i forbindelse med fysisk eller psykisk belastning (se afsnit om ’Stressberedskab’), ved seponering eller aftrapning af glukokortikoid behandling (se afsnit om ’Glukokortikoid induceret binyrebarkinsufficiens’), og under behandling med medicin, som hæmmer produktionen eller øger omsætningen af kortisol.
Akut blødning i binyrerne som årsag til akut binyrebarkinsufficiens forekommer i sjældne tilfælde hos patienter med sepsis forårsaget af meningokokker eller pseudomonas (Waterhouse-Friderichsens syndrom), men kan også udløses af antikoagulationsbehandling samt koagulationssygdom. Tilstanden er beskrevet som komplikation til graviditet, antifosfolipid syndrom og idiopatisk binyrevenetrombose. CT-scanning af abdomen kan afsløre bilateralt forstørrede binyrer med tegn til blødning.
Akut binyrebarkinsufficiens kan tilsvarende ses i relation til pituitær apopleksi.
Symptomer og kliniske fund:
Det kliniske billede er domineret af en svært påvirket almentilstand med varierende grader af hypotension (systolisk BT < 100 mmHg), dehydrering, diffuse mavesmerter, kvalme og opkastninger, diarré, feber, udmattelse, og i svære tilfælde konfusion og evt. koma. Hypovolæmisk shock forekommer især hos patienter med primær binyrebarkinsufficiens grundet mangel på mineralokortikoid og responderer ikke på væskebehandling eller inotropisk støtte(21).
Akut binyrebarkinsufficiens bør mistænkes i følgende kliniske situationer:
- Akut sygdom hos en patient kendt med kronisk binyrebarkinsufficiens
- Akut sygdom hos en patient i behandling med glukokortikoider, herunder også inhalations-steroider og steroider til udvortes brug
- Uafklaret hypotension, eventuelt i kombination med elektrolytforstyrrelser
- Sepsis og cirkulationssvigt, som ikke responderer på standard behandling
- Patienter med svært påvirket almen tilstand eller langtrukket forløb, som ikke står i forhold til den formodede udløsende sygdoms natur
- Kraftige mavesmerter (pseudoperitonitis) hos akut dårlige patienter
- Ved typiske biokemiske fund: hyponatræmi, hyperkaliæmi (kun primær binyrebarkinsufficiens), prærenal uræmi, og hypoglykæmi (hyppigst hos børn) og metabolisk acidose.
Udredning
- Kendt binyrebark insufficiens:
- udredning rettes mod at identificere udløsende årsag
- Mistænkt binyrebarkinsufficiens:
- Kortisol, ACTH (hvis patienten er kardiovaskulær stabil udvides med synacthen test)
- Er det ikke muligt at tage prøver fra før opstart af hydrokortison/SoluCortef må man ved opretholdt mistanke tage prøver i stabil fase
- Tolkning af biokemi bør foretages i samråd med endokrinolog
- OBS! Måling af kortisol og ACTH er uden værdi under behandling med glukokortikoider
Behandling
Akut binyrebarkinsufficiens er en livstruende tilstand, som kræver AKUT behandling(13, 21-23). Ved mistanke om akut binyrebarkinsufficiens skal patienten omgående have tilført 100 mg hydrokortison i.v./i.m., gerne præhospitalt og INDLÆGGES AKUT.
- Solu-cortef® (Hydrokortison)
- 100 mg gives i.v. straks over 1 – 2 minutter.
- Yderligere 200 mg hydrokortison som kontinuerlig intravenøs infusion over de første 24 t.; alternativt som refrakte injektioner hver 6. time (50 mg x 4 i.v.). Solu-cortef® kan blandes i isoton glukose eller saltvand
- Væskebehandling
- isoNaCl titreres iht. behov og p-Na – det første døgn ofte omkring 3 liter. Monitorering af p-Na i hht ’NBV hyponatriæmi’
- Obs. forsigtighed hos ældre hjertesyge
- Obs. forsigtighed hos patienter med sekundær/tertiær binyrebarkinsufficiens i samtidig behandling med desmopressin
- Isoton glukose gives ved hypoglykæmi
- OBS!Søg efter og behandl udløsende årsag.
- Parenteral hydrokortison kan oftest skiftes til tabletbehandling efter 1-3 dage, med efterfølgende gradvis nedtrapning til vanlig substitutionsdosis
- Så længe patienten har gastrointestinale symptomer, gives Solu-cortef® i.v.
- Tillæg af mineralokortikoider er unødvendig, så længe hydrokortison dosis er over 50 mg pr. døgn.
Glukokortikoid-induceret binyrebarkinsufficiens
Ætiologi og forekomst: Glukokortikoid-induceret binyrebarkinsufficiens opstår ved at glukokortikoidholdige lægemidler supprimerer CRH fra hypothalamus og ACTH fra hypofyse.
Under pågående behandling eller initialt efter seponering af peroral glukokortikoid behandling har omkring halvdelen af patienterne binyrebarkinsufficiens. Det skønnes at forekomsten er omkring 25% 6 mdr. efter seponering(5, 6).
Risikoen for at udvikle glukokortikoid-induceret binyrebarkinsufficiens er størst ved anvendelse af potente glukokortikoider, ved systemisk, langvarig, og højdosis behandling. Binyrebarkinsufficiens forekommer dog også ved lokal administrerede glukokortikoider, kortvarig eller lavdosis behandling, fx vist hos 8% af patienter i behandling med inhalationssteroid, 52% efter intraartikulær injektion, og mere end en tredjedel af patienter i langvarig lavdosis (5 mg) prednisolonbehandling(5, 6).
Diagnostik: Medmindre kortisol analyseres ved massespektrometri er der behov for pausering af glukokortikoider inden synacthentest for at undgå falsk forhøjede P-kortisol pga. krydsreaktivitet i assayet. Udover den rene metodemæssige problematik med krydsreaktivitet, må tidspunktet for test tilrettelægges afhængig af den kliniske situation inkl. anvendte glukokortikoid.
Klinik: Den kliniske betydning af glukokortikoid-induceret binyrebarkinsufficiens, vurderet som et nedsat respons til en synacthentest er uklart, hvorfor der hverken findes international evidens eller konsensus for håndtering af disse patienter(24, 25). Det er en heterogen patientgruppe, da patienterne dels har meget varierende grad og varighed af den supprimerede binyrebarkfunktion. Symptomerne er ofte uspecifikke, vil afhænge af graden af stress og kan ofte ikke klart skelnes fra symptomer fra grundsygdom eller fra den fx infektion, der øger glukokortikoidbehovet.
Det må formodes, men er ikke vist, at patienter med svær supprimeret binyrefunktion vil have gavn af substitutions behandling, men det er især uklart, hvordan patienter med mild-moderat supprimeret binyrefunktion bedst behandles. Da akut binyrekrise er en livstruende tilstand, tilrådes dog opmærksomhed og behandling ud fra et forsigtighedsprincip ved svær sygdom og stress.
Klinisk betydende binyrebarkinsufficiens kan opstå ved seponering af glukokortikoidbehandling samt under pågående glukokortikoidbehandling, hvis summen af glukokortikoid produktion og indtag ikke matcher kroppen behov.
Forslag til patienthåndtering kan opdeles i 2 kliniske situationer:
- Ved seponering af glukokortikoid behandling:
- For nuværende findes ikke evidens for rutinemæssig udførelse af Synacthen test ifm. seponering af glukokortikoider. Ej heller evidens for en gavnlig effekt af rutinemæssig substitutions behandling af denne patientgruppe.
- Ved mistanke om binyrebarkinsufficiens, bør der udføres en Synacthen® test, og ved insufficiens bør endokrinologisk afdeling vurdere patienten mhp. information om tilstand inkl. forholdsregler ved stress samt stillingtagen til substitutionsbehandling.
- Man skal være opmærksom på, at de uspecifikke symptomer ved binyrebarkinsufficiens, og symptomoverlap med grundsygdom, kan komplicere den kliniske skelnen mellem genopblussen af grundsygdom og binyrebarkinsufficiens.
- Under fortsat glukokortikoid behandling:
- Afhængig af glukokortikoid dosis kan patienten have brug for supplerende doser ved stress (hydrokortison el. fx prednisolon).
- Ved enhver alvorlig sygdom, større legemsbeskadigelse eller operation samt ved opkastning eller diarre skal patienten håndteres som enhver anden patient med Addison krise.
- Der er ingen evidens for anvendelse af stressdoser ved mild-moderat sygdom eller stress. De engelske endokrinologiske og reumatologiske selskaber har lavet særlige (konsensus baserede) retningslinjer for øgning af prednisolondosis hos patienter i prednisolonbehandling med COVID-19(25).
Opioid-induceret binyrebarkinsufficiens
- Kronisk opioid behandling kan medføre hæmning af HPA-aksen via påvirkning af hypotalamus’ CRH-sekretion (13, 26-28).
- Det skønnes at 9-15% af patienter med et kronisk opioidforbrug har tertiær binyrebarkinsufficiens. Det er observeret i morfin ækvivalente døgn doser ≥ 20 mg, og risikoen stiger med den kumulative dosis.
- For nuværende findes ingen guidelines der anbefaler rutinemæssig screening for binyrebarkinsufficiens hos patienter i kronisk opioid behandling. Man bør overveje udredning ved uspecifikke symptomer hos denne patientgruppe, særligt ved langvarig behandling og høj daglig dosis. I et review fra Mayo Clinic anbefales ved mistanke om opioidinduceret binyrebarkinsufficiens initial måling af morgen basal kortisol og ACTH (og DHEAS), og afhængig af udfald stillingtagen til supplerende Synacthen test og/eller insulin tolerance test(27).
- Som ved andre former for sekundær/tertiær binyrebarkinsufficiens vil brugbarheden af et sufficient respons på Synacthen testen afhænge af hvor længe hæmningen af HPA-aksen har stået på og om der kun er tale om en partiel hæmning af HPA-aksen. Ved stor klinisk mistanke trods sufficient respons på Synacthen test må der gøres individuel vurdering, og evt opstartes hydrokortison behandling imens opioid forsøges udtrappet (29).
- Data på ”recovery” af HPA-aksen efter udtrapning af opioid er relativt sparsomme, men tyder på en høj grad af ”recovery”. Udtrapning (alternativt nedtrapning) bør således være målet hos patienter med opioid-induceret binyrebarkinsufficiens. Synacthen test bør gentages efter udtrapning (28).
Graviditet og binyrebarkinsufficiens
Patienter med binyrebarkinsufficiens bør ved graviditet følges i et specialiseret samarbejde mellem gynækolog, obstetriker og endokrinolog.
Diagnostik (13, 30, 31)
- Graviditet fører til en gradvis fysiologisk stigning i mængden af CBG og dermed i total kortisol. I sidste trimester øges også mængden af frit kortisol.
- Tolkning af basal kortisol og Synacthen® test bør ske i samråd med endokrinolog grundet risiko for fejltolkning af testresultatet
- Foreslåede minimumsværdier i henholdsvis 1. og 2. og 3. trimester – se tabel 6. Relativt lave trimester afhængige kortisol-værdier indikerer yderligere opfølgning og stillingtagen til behandling.
- Insulin-hypoglykæmi test er kontraindiceret under graviditet.
Tabel 5. Foreslåede minimumskoncentrationer for morgen P-kortisol, samt for 30 minutters kortisol under Synacthen test. Koncentrationer under de angivne grænser bestyrker mistanken om binyrebarkinsufficiens uafhængigt af ætiologi. Modificeret efter Lebbe et al(30).
| Basal p-kortisol | 30 min p-kortisol (Synacthen test) | |
| 1. trimester | 300 nmol/L | 690 nmol/L |
| 2. trimester | 450 nmol/L | 800 nmol/L |
| 3. trimester | 600 nmol/L | 880 nmol/L |
Behandling
Behandling med fysiologiske doser af hydrokortison og mineralokortikoid er ikke forbundet med teratogenicitet eller føtale komplikationer(13).
Glukokortikoid:
- Vanlig dosis hydrokortison bibeholdes i starten af graviditeten
- I 3. trimester vil nogle patienter have behov for 20-40 % øgning i hydrokortison. Justeringen foretages på baggrund af klinik. Løbende bestemmelse af P-kortisol og ACTH er ikke relevant for monitorering
- Øget opmærksomhed på gestationel diabetes mellitus tilrådes
- Fra regelmæssige veer gives dobbelt vanlig dosis hydrokortison. Denne dosis opretholdes i fødselsdøgnet, hvorefter der hurtigt reduceres til vanlig dosis.
- I tilfælde af kompliceret fødselsforløb, sectio eller symptomer på binyrebark insufficiens gives 50 mg hydrokortison. Derefter følges princippet for major-kirurgi med 50 mg hydrokortison hver 8. time, enten peroralt eller i.v.
Mineralokortikoid (primær binyrebarkinsufficiens):
- Serum progesteron øges under graviditet, og progesteron binder sig kompetitivt til mineralkortikoid receptoren (anti-mineralokortikoid effekt), hvorfor der oftest er et øget behov for fludrokortison (Florinef®) i sidste halvdel af graviditeten
- Justeres ud fra BT og s-kalium. P-renin kan under graviditeten ikke bruges til monitorering, grundet fysiologisk stigning.
Outcome
Kvinder med velbehandlet primær binyrebarkinsufficiens gennemgår generelt ukomplicerede graviditeter, dog har en svensk undersøgelse vist forøget risiko for præ-term fødsel (OR, 2.61; 95% CI, 1.69-4.05)(32-35).
Thyroideasygdom
Hypertyreose: øger kortisolomsætningen og hydrokortisondosis bør øges, undertiden til dobbelt dosis indtil patienten er euthyroid
Ved samtidig hypotyreose, skal patienten substitueres med hydrokortison inden opstart af thyroxin behandling, som kan accelerere metabolisering af kortisol.
Kirurgi hos patienter med binyrebarkinsufficiens
Kirurgisk stress er en potent aktivator af HPA aksen. Ved major kirurgi stiger kortisol sekretionen hos den ikke-binyrebarkinsufficiente fra omkring 10 mg/dag, til 75-150 mg/dag i det første postoperative døgn. Kortisolniveauet normaliseres 48-72 timer postoperativt, såfremt forløbet er ukompliceret.
Patienter med binyrebarkinsufficiens, uafhængigt af ætiologi, er derfor afhængige af øget tilførsel af glukokortikoid i forbindelse med operative indgreb. Forslag til supplerende glukokortikoidbehandling i forbindelse med operative indgreb er angivet i Tabel 5. Doser er vejledende og kan være utilstrækkelige ved komplikationer, herunder infektion. Glukokortikoidbehandling nedsætter sårheling og øger risiko for hyperglykæmi og infektion, hvorfor dosisøgning i ukomplicerede tilfælde ikke fortsættes længere end skitseret.
Tabel 6: Forslag til supplerende glukokortikoidbehandling i forbindelse med operative indgreb hos patienter med binyrebarkinsufficiens uafhængigt af ætiologi. Doser er vejledende og kan være utilstrækkelige ved komplikationer, herunder infektion. Modificeret efter (36, 37)..
| Kirurgisk stress | Præoperativt | Operationsdøgnet | Postoperativt |
| Minimal Fx hudbiopsi, rutine tandarbejde, phacoemulsifikation | Vanlig dosis | Vanlig dosis | Vanlig dosis |
| Minor Fx artroskopi, coloskopi, laparoskopi, multiple tandekstraktioner | Vanlig dosis, peroralt eller i.v. (ved faste) | 25 mg Hydrokortison i.v. ved anæstæsiinduktion, herefter dobbelt vanlig dosis, peroralt eller i.v. | 1.døgn: Dobbelt vanlig dosis, peroralt Herefter vanlig dosis |
| Moderat Fx abdominal hysterektomi, knæ- eller hoftealloplastik, åben cholecystektomi | Vanlig dosis, peroralt eller i.v. (ved faste) | 25 mg Hydrokortison i.v. ved anæstæsiinduktion, herefter 75 mg Hydrokortison i.v./døgn (25 mg x 3) | 1. døgn: 75 mg Hydrokortison i.v./døgn (25 mg x 3) 2.. døgn: Dobbelt vanlig dosis, peroralt, eller i.v. Herefter vanlig dosis |
| Major Fx thoraxkirurgi, Whipples operation, leverresektion | Vanlig dosis, peroralt eller i.v. (ved faste) | 50 mg Hydrokortison i.v. ved anæstæsiinduktion, herefter 150 mg Hydrokortison i.v./døgn (50 mg x 3) | 1.døgn: 150 mg Hydrokortison i.v./døgn (50 mg x 3) 2. døgn: 75 mg Hydrokortison i.v./døgn (25 mg x 3) 3. døgn: Dobbelt vanlig dosis, peroralt, eller i.v. Herefter vanlig dosis |
Kirurgi hos patienter i behandling med glukokortikoider
Sikre grænser kan ikke fastsættes, men særlig årvågenhed anbefales ved:
- patienter i fast behandling med ≥ 2,5 mg prednisolon/døgn eller
- patienter i tidligere fast behandling der er seponeret indenfor de seneste 3 måneder
Ved verificeret binyrebarkinsufficiens eller ved tvivl, i situationer, hvor forholdene ikke tillader Synacthen® test efter forskrifterne, håndteres patienterne jf. Tabel 5.
Man bør være opmærksom på, at ovenstående anbefalinger dækker behovet for kortisol under kirurgi, men tager ikke højde for evt. større behov for at undgå aktivering af grundsygdom. Såfremt man ønsker at fastholde den antiinflammatoriske effekt, bør det øgede behov dækkes ved tillæg af syntetiske glukokortikoider (ex prednisolon/Solu-Medrol®) frem for øget hydrokortisondosis for at minimere uhensigtsmæssig mineralokortikoid effekt.
Særlige former – primær binyrebarkinsufficiens
Se Appendiks I
Prognose
Litteraturen vedrørende prognosen for patienter med binyrebarkinsufficiens er sparsom.
Et norsk studie af 811 patienter med diagnosen Mb Addison/Primær binyrebarkinsufficiens identificeret via et landsdækkende diagnoseregister rapporterer at standard-mortalitetsraten (SMR) for hele gruppen ikke er signifikant forhøjet, men blandt patienter, hvor diagnosen er stillet inden 40-årsalderen, er der en signifikant forhøjet SMR (kvinder/mænd) = 1,5 / 2,0(38). Et svensk studie baseret på i alt 3299 personer med Mb. Addison eller binyrebarkinsufficiens som led i et polyglandulært syndrom, finder en SMR for hele gruppen på (kvinder/mænd) = 2,9 / 2,5(39). I lighed med det norske studie er risikoen højst hos yngre, men også signifikant øget i de ældre aldersgrupper.
Mht. årsag til den øgede mortalitet tyder begge studier på at akut binyrebarkinsufficiens er en væsentlig forklaring på den øgede dødelighed i de yngre aldersgrupper.
I et fælles europæisk studie med 801 patienter med primær binyrebarkinsufficiens og 1233 patienter med sekundær binyrebarkinsufficiens fra Tyskland, Holland, Sverige og United Kingdom, observeret i op til 8 år, fandt man kardiovaskulær sygdom og infektioner som de hyppigste dødsårsager, hvorimod der ikke fandtes cancerdødsfald(40). Patienter der døde var karakteriseret ved at være ældre, med en overrepræsentation af mænd og en høj hyppighed af Addisons krise.
For at nedbringe denne øgede mortalitet taler de foreliggende studier således for en fokuseret indsats på forebyggelse og hurtig behandling af alle patienter i relation til akut binyrebark insufficiens.
Opfølgning
Ambulant forløb:
Opfølgning af patienter med binyrebarkinsufficiens varetages af speciallæger i endokrinologi. Patienter med nyopdaget binyrebarkinsufficiens ses hver 3.-6. måned til klinisk vurdering, suppleret med kontrol af biokemiske parametre. Velsubstituerede patienter har ofte kun behov for planlagt kontrol 1 x årligt.
Ved kontrolbesøgene foretages blodprøver, objektiv undersøgelse, samt fokus på:
- Subjektivt velbefindende og livskvalitet
- Symptomer relateret til over- og underdosering (se Tabel 7)
- Symptomer/kliniske tegn på andre autoimmune sygdomme (se Tabel 8)
- Optimering af substitutionsbehandlingen
- Vurdering af medicin compliance
- Patientuddannelse.
Forslag til årsprøver(16):
- Uanset ætiologi: natrium, kalium, kreatinin (evt carbamid, calcium-ion, hgb, albumin)
- Ved primær binyrebarkinsufficiens på autoimmun basis kan der årligt suppleres med HbA1c, TSH og B12. Calcium ion og transglutaminase bør måles lejlighedsvis. Se i øvrigt afsnittet ” Screening for andre autoimmune sygdomme” nedenfor.
- P-renin kan bruges vejledende for justering af Florinef® dosis, dog ikke hos gravide.
- Enkelt måling af P-kortisol og P-ACTH kan ikke anvendes til justering af dosis af hydrokortison.
Øvrige:
- Der er ikke evidens for en øget risiko for osteoporose eller øget forekomst af frakturer hos patienter med binyrebarkinsufficiens i forhold til baggrundsbefolkningen, hvis syntetiske steroider undgås og substitutionsdosis af hydrokortison holdes under 0,3 mg/kg. Dog har enkelte studier vist en negativ påvirkning på BMD i columna og i hoften under standard substitutions-behandling, hvorfor den ”Europæiske konsensus statement” foreslår en DXA-skanning hvert 3. – 5. år (41).
I fravær af oversubstituering eller associerede endokrinopatier gælder der samme retningslinjer for udredning og behandling af osteoporose som for befolkningen i almindelighed (Se NBV om NBV for osteoporose og NBV om mandlig osteoporose).
Tabel 7: Kliniske og parakliniske indikatorer tydende på en inadækvat substitutionsbehandling.
| Substitutionspræparat | Overdosering | Underdosering |
| Hydrokortison | Cushingoid udseende Vægtstigning Forhøjet blodtryk Metabolisk syndrom Osteoporose | Træthed, manglende energi Vægttab, nedsat appetit Vedvarende hyperpigmentering Myalgia, artralgia Hypotension Hyponatriæmi |
| Florinef® | Forhøjet blodtryk Væskeophobning – ødemtendens Hypokaliæmi Muskelsvaghed | Hypotension, Ortostatisk svimmelhed Salthunger Hyponatriæmi, hyperkaliæmi Øget plasma renin |
Screening for andre autoimmune sygdomme
Hos patienter med autoimmun primær binyrebarkinsufficiens ses en øget forekomst af andre autoimmune sygdomme. Patienterne udspørges om relevante kliniske symptomer og på klinisk begrundet mistanke bestemmes der supplerende biokemiske parametre (Tabel 8). Patienter med gastrointestinale gener bør screenes for cøliaki. Patienter med ikke intenderet vægttab bør undersøges for thyrotoksikose, cøliaki og diabetes. Alternativt skal underdosering med hydrokortison overvejes(16).
Tabel 8: Udvidet blodprøvepanel ved klinisk mistanke om associeret autoimmun sygdom.
| Autoimmun sygdom | Blodprøver |
| Type 1 diabetes | HbA1c, GAD65-antistof, fastende c-peptid |
| Hypo- eller hyperthyroidisme | TSH, T3, T4, TPO-antistoffer, TSH-receptor antistoffer (TRAB) |
| Hypoparathyroidisme | PTH, Ca-ion |
| Perniciøs anæmi | B-12, Methylmalonat (MMA), Parietalcelleantistoffer, Intrinsic factor-antistoffer |
| Præmatur ovarie insufficiens | FSH, LH, østradiol, (AMH) |
| Cøliaki | Transglutaminase antistoffer, IgA |
Patientuddannelse
Patientuddannelse er forudsætningen for forebyggelse af akut binyrebarkinsufficiens og skal bl.a. omfatte vejledning om:
- Øgning af peroral hydrokortison dosis ved sygdom eller stresssituationer
- Behov for AKUT lægehjælp i tilfælde af akut svær sygdom, eller vedvarende opkastninger eller diare, hvor i.v. tilførsel af Solu-cortef® er nødvendig.
- Selvadministration af SoluCortef® i.m. i tilfælde af akut sygdom.
- Patienter sikres praktisk instruktion og oplæring i selvinjektion af Solu-cortef® som medbringes ved udenlandsrejser (husk medicinattest ved flyrejser).
- Patienter eller pårørende informeres om at give 100 mg SoluCortef® i.m., i de situationer hvor de er ude af stand til at fortsætte peroral behandling, f.eks. grundet opkastninger, diarre eller af andre årsager.
- Patienterne udstyres med et standardiseret internationalt krisekort, som altid skal medbringes ved kontakt til læge, tandlæge, hospital eller udenlandsrejser.
- Krisekortet kan bestilles ved henvendelse til sekretær i Addison Foreningen, med oplysning om modtager navn og fulde adresse, reference (helst personreference), afdelingens EAN nr. Foreningen sender herefter kortene til afdelingen og udsteder en elektronisk faktura. Pris på kortene inkl. Porto: 25 stk. 100 kr., 50 stk. 200 kr. og 100 stk. 350 kr.
- Patienter opfordres til medlemskab af Addison Foreningen i Danmark.
- Via Addison foreningen findes link til ex. video der guider i administration af SoluCortef. https://www.addison.dk/
Forside og bagside på internationalt krisekort:

Perspektiv – nye behandlingsmodaliteter
Serumprofilen af kortisol opnået ved standard substitutionsbehandling efterligner ikke til fulde den fysiologiske døgnvariation af kortisol. Misforholdet mellem kortisolniveauet i blodet og det fysiologiske behov, med jævnlig overeksponering for kortisol i dagtimerne og særligt sidst på eftermiddagen, er blevet sat i relation til metabolisk syndrom og øget kardiovaskulær risiko(42). Nye hydrokortison-præparater med modificeret frigivelse, f.eks. Plenadren, har vist en mere fysiologisk kortisol profil. Overkrydsningsstudier har vist at behandling med Plenadren medførte en lille reduktion i steroid døgneksponering, vægt, blodtryk og HbA1C, livskvalitet, træthed samt normalisering af den immunologiske celle-profil (38-42). Imidlertid afventes studier med tilstrækkelig styrke til evaluering af hårde endepunkter som fraktur, kardiovaskulære events og død Betydningen af den ultradiane kortisol sekretion er uafklaret og imødekommes ikke af nogle af de tilgængelige behandlinger. Aktuelt foreligger der ikke blindede RCT der sammenligner effekten af hydrokortison overfor Plenadren eller hydrokortison pumpebehandling, endsige studier der tager højde for den ændrede biotilgængelighed ved anvendelse af Plenadren sammenlignet med gængs hydrokortison.
Appendiks I
Autoimmun Polyglandulært Syndrom (APS)(43):
Autoimmun primær binyrebarkinsufficiens optræder isoleret i ca. 40 % af tilfældene og i ca. 60 % af tilfældene associeret med andre autoimmune sygdomme. Autoimmun polyglandulært syndrom (APS) optræder i 4 former, APS type I – APS type IV.
- Autoimmun APS type I
Hovedkomponenter er autoimmun primær binyrebarkinsufficiens (Morbus Addison), hypoparathyroidisme samt kronisk mucocutan candidiasis. Andre endokrine og ikke endokrine manifestationer kan forekomme (autoimmun type 1 diabetes, autoimmun thyroideasygdom, alopeci, emalie dysplasi af tænder mv.)
– Prævalensen meget varierende fra 12 pr. million i Norge til 40 pr million i Finland. Debut tidligt i barnealderen, men stor fænotypisk variation.
– Ætiologien er autosomal resseciv mutationer i AIRE (autoimmun regulator) genet.
– Diagnostik og behandling af binyrebarkinsufficiens følger de anførte retningslinjer ved primær binyrebarkinsufficiens. – Et svensk studie beskriver øget incidens og dødelighed af cancer (SMR = 1,1). Opdelt på organ var risikoen øget for mundhule cancer, non-melanom hudcancer og cancer i de mandlige kønsorganer.
- Autoimmun APS type II
Definitorisk en kombination af autoimmun primær binyrebarkinsufficiens (100 %) med mindst én af følgende autoimmune sygdomme; autoimmun thyroideasygdom (70-80%) og/eller autoimmun type 1 diabetes mellitus (30-50%). Herudover kan en række andre autoimmune sygdomme optræde; f.eks. vitiligo, perniciøs anæmi, præmatur gonadeatrofi.
– Prævalensen er estimeret til ca.15 pr. million. Forekomme i alle aldre, hyppigst i 20–50-årsalderen, ca. 3 gange hyppigere hos kvinder end mænd.
– Diagnostik og behandling af binyrebarkinsufficiens følger anførte retningslinjer ved primær binyrebarkinsufficiens. - Autoimmun APS type III
Involverer de samme lidelser som APS type 2 fraset binyrebarkinsufficiens. Består oftest af en kombination af autoimmun thyroideasygdom og autoimmun type 1 diabetes, samt evt. vitiligo eller autoimmun gastrit og perniciøs anæmi. - Autoimmun APS type IV:
Autoimmun binyrebarkinsufficiens, autoimmun gastritis, vitiligo, coeliaki, alopeci (men ikke autoimmun thyroidea sygdom eller T1DM)
Adrenoleukodystrofi (X-ALD)(44):
- X-bunden adrenoleukodystrofi (X-ALD) er en monogen sygdom forårsaget af mutationer i ABCD1 genet, som koder for peroxisomal ABC-transporter, medførende en defekt degradering af de meget langkædede fede syrer (VLCFA) i peroxisomer – og som følge heraf akkumulering af VLCFA i forskellige væv og kropsvæsker.
- Neurodegenerativ lidelse, som præsenterer sig fænotypisk med et heterogent klinisk billede varierende fra adrenomyeloneuropati til den progressive cerebrale ALD. Mindst 6 forskellige fænotyper er beskrevet, men ingen korrelation mellem genotype og fænotype.
- Incidens rate for X-ALD hos mænd er ca. 1:20.000 – 1:30.000.
- Alle mandlige patienter med primær binyrebarkinsufficiens og negativ binyrebark autoantistof bør screenes for X-ALD, enten ved analyse for ABCD1 genet eller ved måling af de meget langkædede fedtsyrer i en serumprøve (VLCFA). VLCFA er forhøjet i plasma hos alle mænd med X-ALD, uafhængig af alder, sygdomsvarighed, metabolisk status og kliniske symptomer, men detekterer kun 85 % af kvindelige heterozygote bærere. Undersøgelse for mutationer i ABCD1 genet udføres på de klinisk genetiske afdelinger som de højt specialiserede afdelinger samarbejder med.
- Aktuelt findes ingen tilfredsstillende behandling som kan forebygge udvikling og progression af den kroniske myelopati ved X-ALD. Peroral indtagelse af en blanding af glyceryl trioleat og glyceryl trierucat – kaldet “Lorenzo’s Oil” – kan undertiden forebygge sygdomsprogression hos asymptomatiske patienter. Stamcelletransplantation synes at være succesfuld hos personer med de tidlige stadier af den cerebrale form for X-ALD.
- Den øvrige diagnostik og behandling af binyrebarkinsufficiens følger de anførte retningslinjer ved primær binyrebarkinsufficiens.
- Behandlingen er centraliseret på højt specialiseret endokrinologisk afdeling.
Adrenogenital syndrom (AGS, kongenit adrenal hyperplasi (CAH))(45):
- Adrenogenital syndrom (AGS), er en gruppe af autosomal recessive sygdomme medførende defekt steroid syntese i binyrerne. AGS på baggrund af 21- hydroxylase defekt er den hyppigste form, og udgør ca. 90 % af alle tilfælde. Incidensen varierer i forskellige etniske grupper fra 1:5.000 til 1:20.000 fødsler (i DK er der 50 – 60.000 fødsler pr år).
- Sværhedsgraden af det kliniske billede er et kontinuum, som afspejler graden og typen af enzymdefekt. Behandlingsmæssigt opdeles AGS i den klassiske og den non-klassiske form, og den klassiske opdeles i subtyperne ”salttabende” (SW) (ca.80%) og ”simpel viriliserende” (SV)/ikke salttabende (ca. 20%). De salttabende former debuterer perinatalt med svær binyrebarkinsufficiens.
- Den klassiske form for AGS er karakteriseret ved glukokortikoid insufficiens og overproduktion af adrenal androgen, med (SW) eller uden (SV) mineralokortikoid insufficiens. Det kliniske billede afspejler dels genotypen, og dels kvaliteten af den langvarige hormonbehandling og kontrol.
- De milde former for AGS, kaldet non-klassisk AGS eller late-onset AGS, er hyppigere; 0,1 – 0,2 % i den kaukasiske befolkning. Debuterer oftest omkring puberteten eller i voksenalderen. Det kliniske billede afspejler varierende grader af androgen overproduktion, og nogle patienter er asymptomatiske. Den milde og subkliniske mangel på kortisol syntese medfører ikke Addison kriser.
- Diagnostisk foretages ACTH-test med måling af kortisol, androgener samt 17-hydroxyprogesteron i plasma til tiderne 0 min, 30 min og 60 minutter. Diagnostiske kriterier for binyrebarkinsufficiens følger den vanlige udredning.
- Behandlingsmålet er at reducere androgen overproduktion ved at substituere de manglende hormoner. Behandling af AGS er en vanskelig balance mellem hyperandrogenisme og hyperkortisolisme. Underbehandling medfører risiko for Addison krise og medfører øget adrenal androgen produktion, ligesom øget forekomst af adrenal makronodulær hyperplasi, og myolipomer. Underbehandling kan hos mænd føre til testikulære adrenale rest tumorer (TART), med ledsagende gonade dysfunktion og infertilitet. Overbehandling kan medføre nedsat vækst, forhøjet blodtryk og iatrogen Cushing’s syndrom.
- Behandlingen er centraliseret på højt specialiseret endokrinologisk afdeling, og kræver involvering af både endokrinologer, gynækologer, plastikkirurger samt genetisk rådgivning og undertiden psykologisk hjælp. Guidelines for evidence-based behandling er publiceret af Endocrine Society i 2010(45).
- VLCFA: Alifatisk carboxylat (C22:0) / Alifatisk carboxylat(C26:0) ratio (NPU01142). Udføres på Metabolisk laboratorium, Klinisk Genetisk Klinik RH 4062, Rigshospitalet, Blegdamsvej 9, 2100 København Ø.
- ABCD1 genmutation (NPU19005): Sekventering af alle kodende DNA-regioner. Udføres på Rigshospitalet, Klinisk genetisk Klinik, Molekylærgenetisk Laboratorium 4062.
- Binyrebark antistof (NPU58204): Antistoffer rettet mod mikrosomale antigener i binyreceller kan påvises hos en større andel af patienter med primær binyrebarkinsufficiens. De specifikke antistoffer påvises meget sjældent hos andre patientgrupper. Analyseres for P-Cytochrom P450 11A1-Ab, P-Cytochrom P450 17A1-Ab og P-Cytochrom P450 21A2-IgG. Prøven sendes til Blodbank og Immunologi, Aarhus Universitetshospital.
Appendiks II
P-Kortisol analyser – udførende laboratorier i DK
| Hospital | Metode/udstyr | Producent |
| Aalborg | Elecsys Cobas | Roche |
| Viborg, Skive, Silkeborg mfl. | Atellica | Siemens |
| Herning | Architect | Abbott |
| Aarhus | Advia Centaur XPT | Siemens |
| Vejle | Elecsys Cobas e801 | Roche |
| Vejle | LC-MS | In house |
| Odense | Immuite XPi | Siemens |
| Køge | Elecsys Cobas | Roche |
| Slagelse | LC-MS | In house |
| Hvidovre | Elecsys Cobas e801 | Roche |
| Herlev/Gentofte | Elecsys Cobas e411 | Roche |
| Bispebjerg/Frederiksberg | Elecsys Cobas e801 | Roche |
| Rigshospitalet | Elecsys Cobas e801 | Roche |
Referencer
- Løvås K, Husebye ES. High prevalence and increasing incidence of Addison’s disease in western Norway. Clinical endocrinology. 2002;56(6):787-91.
- Eaton WW, Rose NR, Kalaydjian A, Pedersen MG, Mortensen PB. Epidemiology of autoimmune diseases in Denmark. Journal of autoimmunity. 2007;29(1):1-9.
- Olafsson AS, Sigurjonsdottir HA. INCREASING PREVALENCE OF ADDISON DISEASE: RESULTS FROM A NATIONWIDE STUDY. Endocrine practice : official journal of the American College of Endocrinology and the American Association of Clinical Endocrinologists. 2016;22(1):30-5.
- Regal M, Páramo C, Sierra SM, Garcia-Mayor RV. Prevalence and incidence of hypopituitarism in an adult Caucasian population in northwestern Spain. Clinical endocrinology. 2001;55(6):735-40.
- Borresen SW, Klose M, Baslund B, Rasmussen Å K, Hilsted L, Friis-Hansen L, et al. Adrenal insufficiency is seen in more than one-third of patients during ongoing low-dose prednisolone treatment for rheumatoid arthritis. European journal of endocrinology. 2017;177(4):287-95.
- Broersen LH, Pereira AM, Jørgensen JO, Dekkers OM. Adrenal Insufficiency in Corticosteroids Use: Systematic Review and Meta-Analysis. The Journal of clinical endocrinology and metabolism. 2015;100(6):2171-80.
- Klose M, Hilsted L, Feldt-Rasmussen U. Method-specific serum cortisol responses to the ACTH test: comparison of two generations of Roche automated immunoassays using polyclonal vs MABs. Endocrine Abstracts 41 EP22. 2016.
- Ueland G, Methlie P, Øksnes M, Thordarson HB, Sagen J, Kellmann R, et al. The Short Cosyntropin Test Revisited: New Normal Reference Range Using LC-MS/MS. The Journal of clinical endocrinology and metabolism. 2018;103(4):1696-703.
- Klose M, Lange M, Rasmussen AK, Skakkebaek NE, Hilsted L, Haug E, et al. Factors influencing the adrenocorticotropin test: role of contemporary cortisol assays, body composition, and oral contraceptive agents. The Journal of clinical endocrinology and metabolism. 2007;92(4):1326-33.
- Javorsky BR, Raff H, Carroll TB, Algeciras-Schimnich A, Singh RJ, Colón-Franco JM, et al. New Cutoffs for the Biochemical Diagnosis of Adrenal Insufficiency after ACTH Stimulation using Specific Cortisol Assays. Journal of the Endocrine Society. 2021;5(4):bvab022.
- Prencipe N, Parasiliti-Caprino M, Gatti F, Penner F, Berton AM, Bona C, et al. Second-Day Morning Cortisol Levels after Transsphenoidal Surgery Are Accurate Predictors of Secondary Adrenal Insufficiency with Diagnostic Cut-Offs Similar to Those in Non-Stressed Conditions. Neuroendocrinology. 2021;111(7):639-49.
- Staby I, Krogh J, Klose M, Baekdal J, Feldt-Rasmussen U, Poulsgaard L, et al. Pituitary function after transsphenoidal surgery including measurement of basal morning cortisol as predictor of adrenal insufficiency. Endocrine connections. 2021;10(7):750-7.
- Hahner S, Ross RJ, Arlt W, Bancos I, Burger-Stritt S, Torpy DJ, et al. Adrenal insufficiency. Nature reviews Disease primers. 2021;7(1):19.
- Husebye ES, Pearce SH, Krone NP, Kämpe O. Adrenal insufficiency. Lancet (London, England). 2021;397(10274):613-29.
- Kehlet H. A rational approach to dosage and preparation of parenteral glucocorticoid substitution therapy during surgical procedures. A short review. Acta anaesthesiologica Scandinavica. 1975;19(4):260-4.
- Bornstein SR, Allolio B, Arlt W, Barthel A, Don-Wauchope A, Hammer GD, et al. Diagnosis and Treatment of Primary Adrenal Insufficiency: An Endocrine Society Clinical Practice Guideline. The Journal of clinical endocrinology and metabolism. 2016;101(2):364-89.
- Wierman ME, Arlt W, Basson R, Davis SR, Miller KK, Murad MH, et al. Androgen therapy in women: a reappraisal: an Endocrine Society clinical practice guideline. The Journal of clinical endocrinology and metabolism. 2014;99(10):3489-510.
- Hahner S, Loeffler M, Bleicken B, Drechsler C, Milovanovic D, Fassnacht M, et al. Epidemiology of adrenal crisis in chronic adrenal insufficiency: the need for new prevention strategies. European journal of endocrinology. 2010;162(3):597-602.
- Smans LC, Van der Valk ES, Hermus AR, Zelissen PM. Incidence of adrenal crisis in patients with adrenal insufficiency. Clinical endocrinology. 2016;84(1):17-22.
- Hahner S, Spinnler C, Fassnacht M, Burger-Stritt S, Lang K, Milovanovic D, et al. High incidence of adrenal crisis in educated patients with chronic adrenal insufficiency: a prospective study. The Journal of clinical endocrinology and metabolism. 2015;100(2):407-16.
- Rushworth RL, Torpy DJ, Falhammar H. Adrenal Crisis. The New England journal of medicine. 2019;381(9):852-61.
- Dineen R, Thompson CJ, Sherlock M. Adrenal crisis: prevention and management in adult patients. Therapeutic advances in endocrinology and metabolism. 2019;10:2042018819848218.
- Nowotny H, Ahmed SF, Bensing S, Beun JG, Brösamle M, Chifu I, et al. Therapy options for adrenal insufficiency and recommendations for the management of adrenal crisis. Endocrine. 2021;71(3):586-94.
- Ahmet A, Mokashi A, Goldbloom EB, Huot C, Jurencak R, Krishnamoorthy P, et al. Adrenal suppression from glucocorticoids: preventing an iatrogenic cause of morbidity and mortality in children. BMJ paediatrics open. 2019;3(1):e000569.
- Mehta P, Meeran K, Macphie E, Abbas A, Rippin J, Jeffery RC, et al. Variability in counselling for adrenal insufficiency in COVID-19 and beyond: a survey of rheumatology practice. The Lancet Rheumatology. 2021;3(2):e92-e4.
- de Vries F, Bruin M, Lobatto DJ, Dekkers OM, Schoones JW, van Furth WR, et al. Opioids and Their Endocrine Effects: A Systematic Review and Meta-analysis. The Journal of clinical endocrinology and metabolism. 2020;105(3):1020-9.
- Donegan D, Bancos I. Opioid-Induced Adrenal Insufficiency. Mayo Clinic proceedings. 2018;93(7):937-44.
- Li T, Cunningham JL, Gilliam WP, Loukianova L, Donegan DM, Bancos I. Prevalence of Opioid-Induced Adrenal Insufficiency in Patients Taking Chronic Opioids. The Journal of clinical endocrinology and metabolism. 2020;105(10).
- Ospina NS, Al Nofal A, Bancos I, Javed A, Benkhadra K, Kapoor E, et al. ACTH Stimulation Tests for the Diagnosis of Adrenal Insufficiency: Systematic Review and Meta-Analysis. The Journal of clinical endocrinology and metabolism. 2016;101(2):427-34.
- Lebbe M, Arlt W. What is the best diagnostic and therapeutic management strategy for an Addison patient during pregnancy? Clinical endocrinology. 2013;78(4):497-502.
- Jung C, Ho JT, Torpy DJ, Rogers A, Doogue M, Lewis JG, et al. A longitudinal study of plasma and urinary cortisol in pregnancy and postpartum. The Journal of clinical endocrinology and metabolism. 2011;96(5):1533-40.
- Björnsdottir S, Cnattingius S, Brandt L, Nordenström A, Ekbom A, Kämpe O, et al. Addison’s disease in women is a risk factor for an adverse pregnancy outcome. The Journal of clinical endocrinology and metabolism. 2010;95(12):5249-57.
- Schneiderman M, Czuzoj-Shulman N, Spence AR, Abenhaim HA. Maternal and neonatal outcomes of pregnancies in women with Addison’s disease: a population-based cohort study on 7.7 million births. BJOG : an international journal of obstetrics and gynaecology. 2017;124(11):1772-9.
- Bothou C, Anand G, Li D, Kienitz T, Seejore K, Simeoli C, et al. Current Management and Outcome of Pregnancies in Women With Adrenal Insufficiency: Experience from a Multicenter Survey. The Journal of clinical endocrinology and metabolism. 2020;105(8):e2853-63.
- Bensing S, Giordano R, Falorni A. Fertility and pregnancy in women with primary adrenal insufficiency. Endocrine. 2020;70(2):211-7.
- Salem M, Tainsh RE, Jr., Bromberg J, Loriaux DL, Chernow B. Perioperative glucocorticoid coverage. A reassessment 42 years after emergence of a problem. Annals of surgery. 1994;219(4):416-25.
- Jung C, Inder WJ. Management of adrenal insufficiency during the stress of medical illness and surgery. The Medical journal of Australia. 2008;188(7):409-13.
- Erichsen MM, Løvås K, Fougner KJ, Svartberg J, Hauge ER, Bollerslev J, et al. Normal overall mortality rate in Addison’s disease, but young patients are at risk of premature death. European journal of endocrinology. 2009;160(2):233-7.
- Bensing S, Brandt L, Tabaroj F, Sjöberg O, Nilsson B, Ekbom A, et al. Increased death risk and altered cancer incidence pattern in patients with isolated or combined autoimmune primary adrenocortical insufficiency. Clinical endocrinology. 2008;69(5):697-704.
- Quinkler M, Ekman B, Zhang P, Isidori AM, Murray RD. Mortality data from the European Adrenal Insufficiency Registry-Patient characterization and associations. Clinical endocrinology. 2018;89(1):30-5.
- Husebye ES, Allolio B, Arlt W, Badenhoop K, Bensing S, Betterle C, et al. Consensus statement on the diagnosis, treatment and follow-up of patients with primary adrenal insufficiency. Journal of internal medicine. 2014;275(2):104-15.
- Plat L, Leproult R, L’Hermite-Baleriaux M, Fery F, Mockel J, Polonsky KS, et al. Metabolic effects of short-term elevations of plasma cortisol are more pronounced in the evening than in the morning. The Journal of clinical endocrinology and metabolism. 1999;84(9):3082-92.
- Kahaly GJ, Frommer L. Polyglandular autoimmune syndromes. Journal of endocrinological investigation. 2018;41(1):91-8.
- Wiesinger C, Eichler FS, Berger J. The genetic landscape of X-linked adrenoleukodystrophy: inheritance, mutations, modifier genes, and diagnosis. The application of clinical genetics. 2015;8:109-21.
- Speiser PW, Azziz R, Baskin LS, Ghizzoni L, Hensle TW, Merke DP, et al. Congenital adrenal hyperplasia due to steroid 21-hydroxylase deficiency: an Endocrine Society clinical practice guideline. The Journal of clinical endocrinology and metabolism. 2010;95(9):4133-60.
Tovholder
Udarbejdet 2016
Seneste revision: Oktober 2021
Næste revision Oktober 2024
Øvrige Forfattere
Simone B. Sneppen, Medicinsk afdeling, Herlev og Gentofte Hospital
Line Bisgaard Jørgensen, Med. endokrinologisk afd. M, Odense Universitetshospital
Torben Leo Nielsen, Med. endokrinologisk afd. M, Odense Universitetshospital
Stina Willemoes Borresen, Medicinsk Endokrinologisk Klinik PE, Rigshospitalet
Ebbe Eldrup, Endokrinologisk Afsnit, Medicinsk afdeling O, Herlev og Gentofte Hospital
Christian Trolle, Medicinsk Afdeling, Diagnostisk Center, Hospitalsenheden Midt
Marie Juul Ørnstrup, Diabetes og Hormonsygdomme, Aarhus Universitetshospital
Konsulenter
Inger Plum, Kemiker, Dansk Institut for ekstern kvalitetssikring for laboratorier i Sundhedssektoren, Rigshospitalet – Glostrup.
Martin Overgaard, Biokemiker, Kemiker, Odense Universitetshospital
Interessekonflikter
Tovholder har ingen interessekonflikter i relation til dette arbejde.