Hvad omfatter denne NBV
Udredning og behandling af testosteronmangel hos mænd >18 år. Testosteronmangel kaldes ofte ”mandlig hypogonadisme”, hvilket dog også inkluderer tilstande med isoleret nedsat spermatogenese. Denne NBV omhandler ikke dette aspekt.
Hvad omfatter denne NBV ikke
- DE23.X Udredning og behandling af hypofysesygdomme, hvor testosteronmangel kan være et element
- DE30.0 Udredning og behandling af pubertas tarda
- DE34.5 Udredning og behandling af androgen receptor resistens
- DN46.9 Udredning og behandling af isoleret nedsat eller ophævet spermatogenese
Diagnosekoder
- DE 29.1 Testikulær dysfunktion
- DE 89.5 Testikulær dysfunktion efter behandling af testikler
- DE 23.0A Isoleret nedsat funktion af gonadotropin
Forkortelser
- LH: Luteiniserende hormon
- FSH: Follikelstimulerende hormon
- SHBG: Seksualhormonbindende globulin
- hCG: Humant chorion gonadotropin
- GnRH: Gonadotropin releasing hormone
- DXA: Dual-energy X-ray absorptiometry
- HPG: hypothalamisk-pituitære-gonade (akse)
Definition
Mandlig testosteronmangel defineres som en tilstand med symptomer og fund tydende på testosteronmangel (2) og samtidigt lavt s-testosteron. Diagnosen beror således på en samlet vurdering.
Forekomst
Testosteronmangel kan opstå i alle aldre; forekomsten blandt danske mænd er ukendt. Ud fra receptdatabaser antages at >5000 mænd i Danmark i 2022 var i behandling med testosteron (Sundhedsdatastyrelsen – Statistikker (medstat.dk)). Primær testosteronmangel er langt hyppigere end sekundær.
Forekomsten af testosteronmangel – uafhængigt af subklassificeringen – er hidtil bedst beskrevet i European Male Aging Study. Her fandt man, at prævalensen af testosteronmangel er stigende med alderen: 40-49-årige 0,1 %; 50-59-årige 0,6 %; 60-69-årige 3,2 % og 70-79-årige 5,1 % (1). Diagnostikken i studiet var baseret på en kombination af lavt testosteron og symptomer på testosteronmangel. I kontrast hertil ville 17 % have haft testosteronmangel, hvis blot diagnosen blev stillet på baggrund af en serumværdi under referenceintervallet, hvilket understreger det væsentlige i at symptomer på testosteronmangel medinddrages i diagnosticeringen (1).
Begrebet funktionel hypogonadisme/testosteronmangel inkluderer hvad der hidtil har været betegnet som Late-onset hypogonadisme (sent indsættende testosteronmangel) (2). Anvendelse af begrebet funktionel testosteronmangel indebærer, at testosteronmangel kan klassificeres som enten organisk (klassisk) eller funktionel. Den organiske testosteronmangel betragtes som irreversibel (genetisk betinget, sequelae til stråleterapi mod testes mm), hvorimod funktionel testosteronmangel kan være reversibel. Som følge heraf skal nogle tilfælde af funktionel testosteronmangel behandles med livsstilsomlægning eller omlægning af medicinsk behandling, og ikke med testosteron.
Den organiske testosteronmangel opstår oftest tidligere i tilværelsen end den funktionelle og er oftest en primær testosteronmangel, hvorimod den funktionelle oftest – men ikke altid – er en sekundær testosteronmangel.
Uagtet subklassificeringen i enten organisk eller funktionel testosteronmangel er udredningen af en potentiel testosteronmangel ens.
Ætiologi
Primær eller sekundær testosteronmangel
Primær testosteronmangel: Lavt testosteronniveau pga. insufficiens af testiklernes testosteronproducerende celler (Leydig celler) medførende øget LH-niveau (hypergonadotrop hypogonadisme). Sekundær testosteronmangel: Nedsat LH-niveau (fra hypofyse) og/eller GnRH-niveau (fra hypothalamus) medførende et lavt testosteronniveau (hypogonadotrop hypogonadisme). Testosteronmangel kan være kombineret primær og sekundær mangel.
Tabel 1. Ætiologi.
| Primær testosteronmangel = hypergonadotrop hypogonadisme | |
| Genetiske | Klinefelter syndrom (47, XXY) |
| XX Male syndrome (46, XX) | |
| 45, X / 46, XY | |
| Gonadal dysgenese | |
| Meget sjældne genetiske defekter med defekt testosteron syntese/virkning | |
| Testikulær sygdom/affektion
| Orkitis, specielt fåresyge med testikulær affektion |
| Orkiektomi | |
| Testistorsion | |
| Kryptorkisme | |
| Kemoterapi, specielt alkylerende medikamenter | |
| Testikulær bestråling | |
| Anorki | |
| HIV | |
| Andre | |
| Sekundær testosteronmangel = hypogonadatrop hypogonadisme | |
| Genetiske
| Kallmanns syndrom |
| Idiopatisk hypogonadotrop hypogonadisme | |
| DAX-1 mutation | |
| Leptin eller leptin receptor mutation | |
| Prader-Willi syndrom | |
| Andre meget sjældne tilstande | |
| Hypofysær/hypothalamisk sygdom | Hypofysetumorer (masseeffekt eller sekundært til hyperprolaktinæmi) |
| Hypofysekirurgi | |
| Pituitær apopleksi | |
| Infiltrative sygdomme eller aflejringssygdomme | |
| Sekundært til tidligere hovedtraume | |
| Cerebral bestråling | |
| Systemisk sygdom | Svær akut eller kronisk sygdom |
| Anoreksia nervosa | |
| Ortoreksi/Relative Energy Deficiency in Sport (RED-S) | |
| Andre | Misbrug af anabole steroider |
| Glukokortikoidbehandling | |
| Morfikabehandling | |
| Kombineret primær og sekundær testosteronmangel | |
| Genetiske | Hæmokromatose |
| Thalassemia | |
| Seglcelle anæmi | |
| Erhvervede | Kemoterapi |
| Strålebehandling | |
Udredning
Symptomer og kliniske fund
Symptomer (2) og objektive fund (Tabel 3) ved testosteronmangel har stor sensitivitet, men lav specificitet (1-3). Forekomsten af de enkelte symptomer afhænger af graden af testosteronmangel (4,5). Der er en individuel dosis-respons-sammenhæng for seksuelle og neurokognitive symptomer, kropssammensætning samt muskelstørrelse- og styrke (6-8). Diagnostiske spørgeskemaer til screening af testosteronmangel anbefales ikke.
Særligt hos ældre mænd er symptomer på testosteronmangel uspecifikke og billedet kan sløres af komorbiditet. Det bør understreges, at nedsat total-testosteron hos ældre mænd ikke betyder, at mænd med alderen generelt får testosteronmangel eller går i ”andropause”.
Tabel 2. Symptomer og fund på testosteronmangel
|
Tabel 3. Objektiv undersøgelse ved mistanke om testosteronmangel
| Alment | Virilisering (kønsbehåring, skægvækst, kropsbehåring), kropsproportioner (maskuline, feminine, eunukoide), muskelfylde, acne, stemmeleje, lugtesans, højde, vægt, BMI, blodtryk |
| Øjne | Synsfelt |
| Thorax/abdomen | Gynækomasti, galaktorré, central adipositas, striae |
| Genitalia externa | Kongenitte misdannelser, testis-størrelse (orkidometer), tumores |
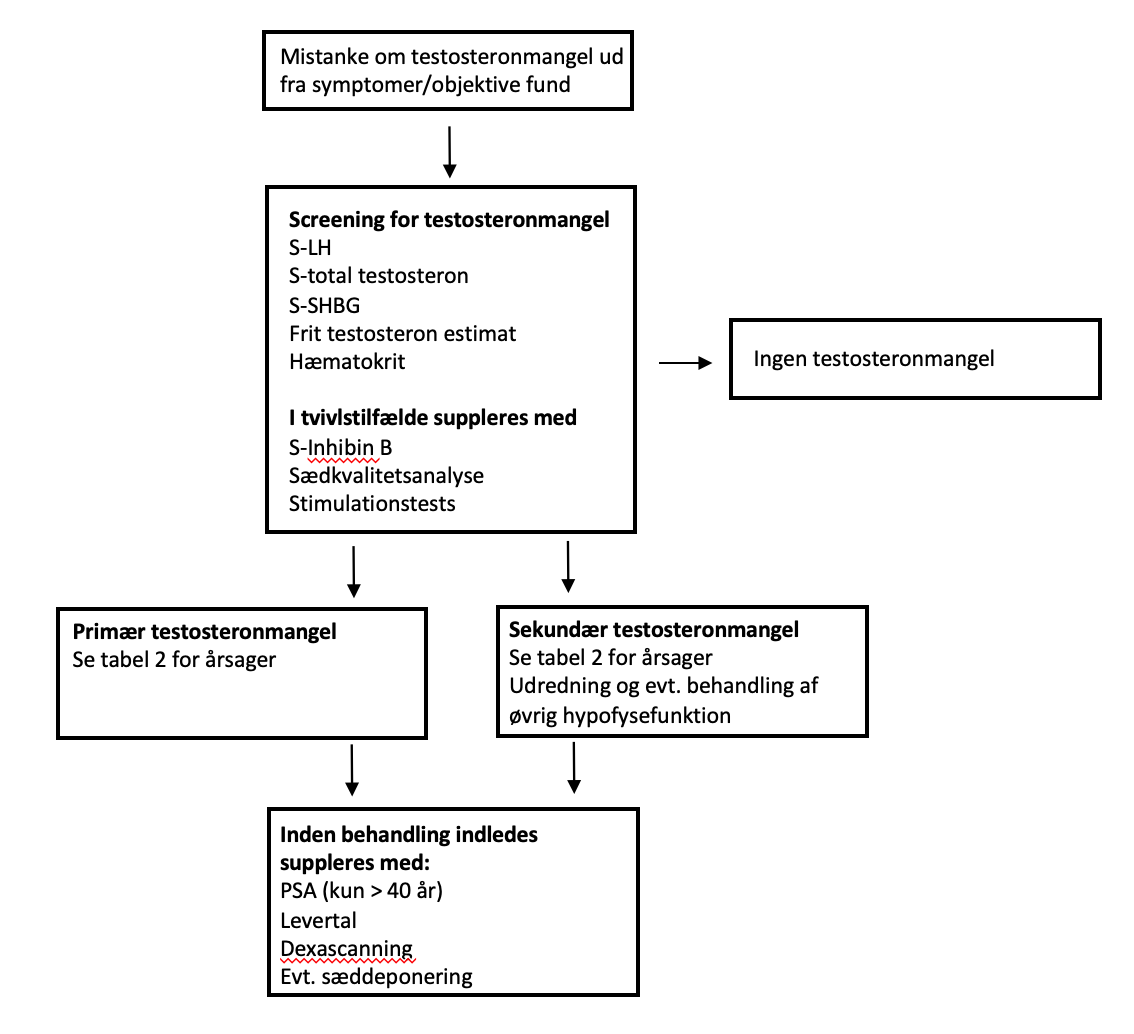
Udredning og initial behandling af patienter mistænkt for testosteronmangel er kompleks og bør foretages af endokrinologer (eller andre speciallæger) med andrologisk specialviden (Figur 1). Udredningen bør forbeholdes patienter med symptomer eller fund tydende på testosteronmangel. Udredningen kan ikke foretages under akut sygdom.
Figur 1.
Kommentar til screening for testosteronmangel(figur 1)
Diagnosen testosteronmangel kræver en detaljeret forståelse af HPG-aksens funktion og testosterons binding til SHBG. Ud fra total-testosteron og SHBG beregnes frit testosteron evt. med inddragelse af albuminniveau. 50-70 % af testosteron i serum er bundet til SHBG og 30-50 % til albumin. Kun cirka 2 % af den cirkulerende testosteronmængde er frit, og det antages, at det er denne frie del, der er den biologisk mest aktive (9). Testosteronkoncentrationen i serum udviser en døgnvariation. Variationen er mest udtalt hos mænd i alderen 30-40 år, hvor total-testosteron er omkring 25% lavere sidst på eftermiddagen end om morgenen. Døgnvariationen er mindre udtalt hos ældre mænd, hvor serumkoncentrationen kun er ca. 5 % lavere om eftermiddagen (9,10). Testosteronkoncentrationen reduceres også af fødeindtagelse. Fund af en normal koncentration af testosteron målt ikke-fastende og om eftermiddagen kan bruges til at udelukke testosteronmangel. Derimod bør diagnosen testosteronmangel bekræftes på en blodprøve taget om morgenen fastende (9,10).
Referenceinterval for s-testosteron afhænger af analysemetoden, hvorfor der ikke opgives referenceværdier i denne NBV. Testosteronniveau anbefales målt ved masse-spektrometri (9).
Testosteronmangel medfører ofte et lavt-normalt eller let nedsat hæmoglobin/hæmatokritniveau.
LH bruges til at skelne mellem primær eller sekundær testosteronmangel. I tilfælde med oplagt normalt testosteronniveau, men forhøjet LH (kompenseret Leydigcelleinsufficiens), er der som udgangspunkt ikke indikation for testosteronbehandling, men testosteronkoncentrationen bør kontrolleres igen efter f.eks. 1-2 år. I udvalgte tilfælde, eksempelvis hos mænd med Klinefelter syndrom, bør der dog startes testosteronbehandling ved kompenseret Leydigcelleinsufficiens, da der allerede på dette tidspunkt oftest er tegn på testosteronmangel i form af nedsat hæmatokrit og energi, øget kropsfedt og nedsat muskelmasse (11-13). Desuden er der typisk neurokognitive forandringer, hvor nogle undersøgelser har indikeret en positiv effekt af testosteronbehandling (13). Den diagnostiske udfordring opstår, hvis patienten har en koncentration af frit testosteron i den lave del af normalområdet. Normalområder afspejler primært testosteronkoncentration i referencebefolkningen, hvorimod det individuelle ”normalområde” kan være snævrere. I sådanne situationer vil det være relevant at overveje udredning med HCG-test for at afklare Leydigcellernes kapacitet.
Hvis resultatet af første blodprøve med sikkerhed viser en normal kønshormonprofil er der ikke indikation for endnu en prøve. Diagnosen testosteronmangel kan derimod ikke stilles ved en enkelt prøvetagning, men skal bekræftes ved gentagen prøve.
Udredning af adipøse mænd for eventuel testosteronmangel er en diagnostisk udfordring. Både total-testosteron og SHBG er lavere ved overvægt og således er frit testosteron principielt uændret. Den relativt øgede koncentration af østradiol ved overvægt bidrager til et øget negativt feedback til hypofysen, der reducerer LH yderligere og mere end hvad testosteronniveauet berettiger til. Det kan derfor hos patienter med svær overvægt resultere i en mindre reduktion af frit testosteron. Den rationelle behandling er vægttab og ikke testosteronsubstitution. Biokemisk kan sekundær testosteronmangel og svær overvægt uden egentlig testosteronmangel synes ens. Testosteronmangel vil i sig selv tendere til at øge serumkoncentrationen af SHBG mens svær overvægt tenderer til at reducere SHBG. Den specifikke diagnose kræver specialistvurdering. Testosteronmangel hos en patient med svær overvægt uden anden forklaring er at betragte som en funktionel testosteronmangel, der ikke skal behandles med testosteron
Ved tvivl om testosteronmangel kan vurdering af sædkvalitet og/eller måling af Inhibin B og FSH (normal Inhibin B og FSH tyder på aktuel spermatogenese) indgå, da normale forhold taler imod testosteronmangel. Normal Inhibin B og sædkvalitet udelukker dog ikke funktionel testosteronmangel.
| Tabel 4 De hyppigste scenarier af kønshormoner og sædkvalitet | |||||||
| Total T | Frit T | SHBG | LH | Inhibin-B | FSH | Sæd-kvalitet | |
| Primær testosteronmangel | ↓ (→) | ↓ | ↑ (→) | ↑ | ↓ (→) | ↑ (→) | ↓ (→) |
| Sekundær testosteronmangel | ↓ (→) | ↓ | ↑ (→) | ↓ (→) | ↓ (→) | ↓ (→) | ↓ (→) |
| Hormonforskydninger grundet svær overvægt | ↓ (→) | → (↓) | ↓ (→) | ↓ (→) | → (↓) | ↑ / ↓ | → (↓) |
| Dopinginducerede hormonforskydninger* | ↑ / ↓ | ↑ / ↓ | ↓ | ↓ | ↓ (→) | ↓ (→) | ↓ (→) |
| Parenteser indikerer mulige, men ikke hyppigste fund | |||||||
| ↓: Nedsat. ↑: Forhøjet. →: Normalt. ↑/↓: Forhøjet eller nedsat | |||||||
| *Oftest ses også høj hæmatokrit/hæmoglobin og let forhøjet ALAT | |||||||
Hormon-stimulationstests
hCG-test
Testosteron måles forud for indgift af hCG (5000 IU im.) samt igen efter 3 døgn (72 timer). Der er ingen bivirkninger eller patientforberedelse til testen, men patienten skal observeres for allergisk reaktion i 30 min efter injektion. Total-testosteron bør stige mindst 7,6 nmol/l. Stigningen blandt eugonade er mediant 20,7 nmol/l (14).
GnRH-test
GnRH-test kan foretages for at vurdere hypofysens kapacitet til at respondere på stimulation med det hypothalamiske hormon GnRH. Normal stigning i LH under testen taler imod en hypofysært betinget testosteronmangel. Testen kan anvendes i de tilfælde, hvor det er svært at skelne mellem egentlig centralt betinget testosteronmangel) og lav koncentration (af især total-testosteron) induceret af svær overvægt, hvor der i førstnævnte tilfælde er indikation for testosteronsubstitution og i sidstnævnte tilfælde ikke skal behandles med testosteron.
LH måles forud for indgift af GnRH (100 ug iv.) samt 30 min efter indgift. Testen kan udføres på alle tider af døgnet og der er ingen patientforberedelse eller bivirkninger, men patienten skal observeres for allergisk reaktion i 30 min efter injektion. LH bør stige mindst
Klomifentest
Klomifentest kan bruges til at vurdere den komplette HPG-akse. Oftest bruges testen til at bekræfte, at en sekundær testosteronmangel er hypothalamisk betinget, når der findes normalt respons ved GnRH-testen eller til at udelukke patologisk funktion af HPG-aksen. Der er ingen gode referencer, der belyser, hvad normalresponset skal være, men man kan tage udgangspunkt i at testosteron bør stige som ved en HCG-test.
Der tages blodprøver (LH og testosteron) om morgenen (kl. 8-9) på dag 1. Derefter udleveres i alt 15 stk. tablet Clomifen á 50 mg. Der skal tages 1 tablet morgen og 1 tablet aften fra og med dag 1 frem til dag 8 (sidste tablet tages om morgenen på dag 8). På dag 8 tages igen blodprøver (LH, og testosteron) om morgenen (kl. 8-9).
Princippet ved alle tre tests er, at et maksimalt opnåeligt hormonniveau sammenlignes med et basalt u-stimuleret. Testene er mest brugbare ved oplagt normalt eller oplagt patologisk respons. Testene kan således ofte hjælpe til at afklare, om et lavt testosteronniveau hos en patient med overvægt er udtryk for sekundær testosteronmangel eller blot er en adaptation til overvægten (2).
Ved doping med testosteron eller andre anabole steroider vanskeliggøres udredning, særligt hvis patienten ikke oplyser om misbrug. En rask person med muskuløs fænotype, trods lavt testosteron, bør give mistanke om misbrug (Tabel 4). Endokrinologisk bør fundet af nedsat SHBG og samtidigt lavt/supprimeret LH lede tanken hen på steroidmisbrug. Supplerende fund af højt eller forhøjet hæmoglobin- eller hæmatokritkoncentration og/eller nedsat serum AMH eller Inhibin B understøtter mistanken (15). Hvis patienten bekræfter misbrug, kan en handlingsplan for stop af misbruget aftales med patienten. Dog bør understreges at eventuel behandling uden forudgående grundig undersøgelse ikke kommer på tale. Det bør ligeledes tales grundigt igennem med patienten at et behandlingsforsøg med testosteronsubstitution i aftagende doser langt fra altid resulterer i bedring i patientens withdrawal-symptomer, efter ophør med steroider. Symptomerne kan være vedvarende. Ved ophør med misbruget kan revurdering foretages efter 6 måneder eller senere. Normalisering af kønshormonprofilen vil oftest være opnået efter cirka 1 år men kan tage længere. Dette gælder især, hvis patienten har anvendt syntetiske steroider, der har lang halveringstid. Det kan man få mistanke om, hvis både testosteronkoncentration, SHBG og LH er lave/supprimerede. Normalisering af fertiliteten tager ofte længere tid, formentlig op til omkring 18-24 måneder (15,16). Et dansk studie har vist, at misbrug af anabole steroider er forbundet med 3 gange øget dødelighed sammenlignet med alderssvarende individer i baggrundsbefolkningen (17). Det kan dog ikke udelukkes at en mere risikofyldt livsstil spiller ind på overdødeligheden.
En lang række bivirkninger er forbundet med misbrug af testosteron eller anabole steroider (Tabel 5) (18,19).
Tabel 5.Bivirkning til misbrug af anabole steroider, inklusiv supra-fysiologisk brug af testosteron
| Organsystem/effekt | Evidens* |
| Det kardiovaskulære system | |
| Dyslipædemi | + |
| Aterosklerose | +/- |
| Kardiomyopati | + + |
| Kardielle overledningsforstyrrelser | + / – |
| Koagulationsforstyrrelser | + |
| Polycytæmi | + + |
| Hypertension | + |
| Det neuroendokrine system | |
| Suppression af gonadeakse ved abstinens | ++ |
| Svækket fertilitet | + + |
| Gynækomasti | + + |
| Prostatahypertrofi | + / – |
| Prostatacancer | + / – |
| Viriliserende effekt | + |
| Neuropsykiatriske symptomer | |
| Mani, hypomani, depression | ++ |
| Aggression, vold | + |
| Afhængighed | ++ |
| Neuronal apoptose, kognitive deficits | + |
| Lever | |
| Kolestatisk effekt | + / – |
| Peilosis hepatis (sjælden) | + / – |
| Neoplasi (sjælden) | + / – |
| Muskuloskeletale effekter | |
| Prematur epifyselukning | + / – |
| Seneruptur | + |
| Renale effekter | |
| Nyresvigt sekundært til rhabdomyolyse | + / – |
| Fokal segmental glomerulo-sklerose | + / – |
| Neoplasi (sjælden) | +/- |
| Nyresvigt sekundært til rhabdomyolyse | + / – |
| Immunsystemet | |
| Immunosuppressive effekter | + / – |
| Dermatologi | |
| Akne | + + |
| Striae pga. hurtig muskelvækst | + |
| + + Velbeskrevet og formodentligt årsag til betydelig morbiditet | |
| + Velbeskrevet, men enten mindre hyppig eller årsag til mindre betydende morbiditet | |
| + / – Mulige risici, men hvor relationen til anabole steroider er mindre godt forstået | |
Behandling
Ved sikker diagnose bør tilbydes testosteronbehandling, hvis der ikke er kontraindikationer og hvis det ikke drejer sig om reversibel funktionel testosteronmangel. For at udelukke udiagnosticeret c. prostata bør der, hos mænd >40 år, foreligge en normal PSA samt foretages rektaleksploration inden behandling påbegyndes (9). I tilfælde, hvor patienten frembyder klassiske symptomer på testosteronmangel men den biokemiske evaluering (total-testosteron, frit testosteron og LH) er i et ”gråzoneområde”, kan behandlingsforsøg med transdermal testosteron i f.eks. 3-6 måneder iværksættes. Behandlingen seponeres, hvis symptomer på testosteronmangel ikke svinder trods sufficient dosis.
En metaanalyse af placebokontrollerede substitutionsstudier har ikke fundet forskel i dødelighed, ny kardiovaskulær sygdom eller øget forekomst af c. prostata (19). Et stort dobbeltblindet randomiseret studie inkluderende over 5000 mænd i alderen 45-80 år, har ikke vist flere kardiovaskulære events (
Valg af medicinsk behandling
Testosteron kan administreres transdermalt, intramuskulært og oralt. De to førstnævnte administrationsformer er principielt ligeværdige førstevalg.
Transdermal administration
Typisk dosis er 20-60 mg dagligt (skuldre/arme/mave/lår)
Fordele: bedre fysiologisk efterligning af kroppens normale testosteronniveauer end ved intramuskulær administration, mulighed for hurtig dosisjustering (fx ved stigning i hæmatokrit), selvadministration.
Ulemper: daglig påsmøring, irritation i smøreområdet, bad i timerne efter påsmøring bør undgås ligesom direkte hudkontakt (påsmurt område) grundet risiko for overførsel af testosterongel til andre.
Intramuskulær administration (depot)
Typisk dosis og interval: 1000 mg hver 10.-16. uge. Kortere og længere intervaller kan dog forekomme, og bestemmes ud fra biokemiske markører, med fokus på at undgå overdosering.
Fordele: Lav administrationshyppighed.
Ulemper: ubehag ved indstiksstedet, mindre god fysiologisk efterligning af kroppens normale testosteronniveauer end ved transdermal administration. Evt. øget forekomst af kardiovaskulære events etc. som beskrevet ovenfor. Svær at selvadministrere.
Testoviron® (250 mg) kan stadig fås og foretrækkes af enkelte patienter. Behandlingen kræver, at behandlende hospitalsafdeling har udleveringstilladelse til præparatet. Nebido® anbefales som standard ved intramuskulær administration.
Oral administration
Oral behandling vælges kun undtagelsesvis pga. varierende absorption og metabolisering. Kapslerne skal indtages i forbindelse med et måltid og synkes hele.
Typisk dosis og interval: Initialt 40-80 mg dagligt fordelt på 1-2 doser. Vedligeholdelsesdosis typisk 120-160 mg dagligt.
Fordele: Selvadministration.
Ulemper: Varierende absorption og metabolisering. Vanskeligt at opnå sufficiente doser pga. den betydelige first-pass-metabolisme i leveren.
Medicinsk kontrol under behandling
3-6 + 12 måneder efter behandlingsstart.
I stabil fase anbefales kontrol hver 12. måned. Ved intramuskulær behandling kan kontroller med længere intervaller (15-18 måneder) anvendes, da tid til steady-state efter interval-ændringer er længere og hyppige justeringer derfor bør undgås.
Registrering af testosteronmangel symptomer. Effekten på symptomer indtræder fra få uger til flere måneder efter påbegyndelse af behandlingen.
Registrering af gener til behandlingen (hudgener, hoste relateret til injektioner).
Registrering af symptomer/tegn på overdosering af testosteron (inkl. BT-måling)
Blodprøver: Testosteron, LH, SHBG, hæmatokrit/hæmoglobin, ALAT.
PSA kontrolleres 3-6 måneder efter behandlingsstart hos >40-årige. Hos <40-årige er der ikke grund til monitorering af PSA. Substitutionsbehandlingen pauseres og der henvises til urologisk udredning, hvis to på hinanden følgende PSA-værdier, ved samtidig udelukkelse af urinvejsinfektion, overstiger den aldersspecifikke grænseværdi (alder under 60 år: > 3,0 ng/ml; alder 60-70 år: > 4,0 ng/ml; alder over 70 år: > 5,0 ng/ml) (24). Behandling kan evt. genoptages, hvis c. prostata ikke diagnosticeres.
DXA efter 2 år, hvis baseline DXA var med T-score ≤ -1.0.
Måling af s-testosteron: Bør måles som dal-værdi ved intramuskulær testosteronbehandling. Ved transdermal behandling kan s-testosteron måles når som helst (dog tidligst 1 uge efter dosis ændring), men i vurderingen af svarene bør man inkludere viden om tidspunkt for prøvetagning i forhold til tidspunkt for applikation af cremen. Hvis patienten har påsmurt cremen i hudområdet hvor blodprøven tages, er der risiko for ”forurening” med en meget høj s-testosteronmåling til følge.
Tegn på overdosering er forhøjet hæmatokrit, væskeretention, blodtryksstigning, nytilkommet aggressivitet, nytilkommet svær acne eller forhøjet libido (se Tabel 5). Patienten kan endvidere opleve øget maskulin hårvækst, fedtet hud, vigende hårgrænse, skægvækst og øget libido, som dog er udtryk for behandlingsvirkning. Symptommonitorering skal ses i relation til patients oprindelige symptomer samt symptomer på overdosering.
Tolkning af blodprøver under behandling
- Generelt: Testosteron doseres individuelt og efter en samlet vurdering af serum niveauer af testosteron, LH, SHBG, hæmatokrit/hæmoglobin og fravær/reduktion af symptomer på testosteronmangel. Hvis fokus er normalisering af total-testosteron hos en patient med overvægt og testosteronmangel, vil dette ofte lede til overbehandling. Behandlingen er livslang ved primær testosteronmangel.
- LH: Ved primær Leydigcelleinsufficiens indikerer et supprimeret LH-niveau behov for dosisreduktion.
- PSA (> 40 år): Kontrolleres med 12-24 måneders interval. Se ovenfor vedrørende betydning af PSA-niveauer.
- Hæmatokrit/hæmoglobin: Ofte gradvis og langsom stigning, men der bør reageres med dosisreduktion i god tid inden polycytæmi udvikles. Ved hæmatokrit >50% reduceres dosis (øget interval ved intramuskulær behandling). Dog kan en stabil hæmatokrit op til 52% være acceptabel, hvis der ikke er andre tegn på overdosering. Ved svær påvirkning kontrolleres hæmatokrit igen 3-6 måneder efter at dosis er blevet reduceret. Venesectio anbefales normalt ikke.
Vedr. pausering eller ophør af behandling
Overvej pausering af behandling ved:
- Hypogonadotrop hypogonadisme forudgået af pubertas tarda.
- Opiatudløst sekundær testosteronmangel, hvor opiatdoser reduceres væsentligt.
- Andre årsager til potentielt reversibelt nedsat testosteronniveau såsom hypofysesygdomme der regredierer (f.eks. ved velbehandlet hyperprolaktinæmi), samt ved manglende bedring af symptomer relateret til testosteronmangel efter 1 års velreguleret behandling.
- Frembrud af bivirkninger/afdækning af underliggende sygdom.
- Mindre alvorlige bivirkninger – nedjuster dosis og revurdér efter 3–6 måneder.
- Alvorlige bivirkninger (svær hjerteinsufficiens, udtalt væskeretention, ukontrollerbar hypertension, forværring af iskæmisk hjertesygdom, c. prostata, c. mammae).
Kontraindikationer til testosteronbehandling
- Sekundær testosteronmangel, hvor binyre- og thyroidea-akserne er påvirkede og endnu ikke substituerede.
- Aktiv c. prostata. Testosteronbehandling kan næppe fremkalde c. prostata, men testosteron kan stimulere allerede tilstedeværende cancerceller til forøget vækst, hvorfor en demaskering af latent c. prostata ikke kan udelukkes.
- Behandling af patienter med behandlet c. prostata bør foregå i samarbejde med urolog og/eller onkolog. Behandlet c. prostata er således ikke en absolut kontraindikation. En eventuel testosteronbehandling bør dog ske med et transdermalt produkt pga. kortere halveringstid i forhold til intramuskulært produkt.
- Levertumorer
- C. mammae
- Fertilitetsønske
- En relativ kontraindikation er svær hjerte-, lever- eller nyreinsufficiens, iskæmisk hjertesygdom eller hypertension. Hos patienter med kredsløbsinsufficiens og hos ældre vil sædvanlig dosering ofte medføre for høje s-testosteron niveauer.
Behandling og fertilitet
Generelt har mænd med testosteronmangel ophævet eller nedsat spermatogenese. Ved primær testis insufficiens er reduceret Leydigcellekapacitet ledsaget af reduceret spermatogenese. Ved sekundær testis insufficiens er stimulationen af testiklerne reduceret grundet reduceret LH- og FSH-sekretion.
Testosteronbehandling medfører reduktion eller ophør af eventuel igangværende spermatogenese. Det øgede testosteronniveau, der opnås ved behandling, medfører øget negativ feedback på hypothalamus- og hypofyseniveau og dermed reduceres GnRH-, FSH- og LH-sekretion. Ved pågående fertilitetsønske eller ved fertilitetsbehandling bør testosteronbehandling derfor ikke påbegyndes. Alternativt kan foretages sæddeponering.
Patienter med Klinefelter syndrom har stort set altid azoospermi, men det er muligt hos cirka 20-50% at isolere brugbare sædceller ved kirurgisk indgreb. Allerede igangsat testosteronbehandling skal seponeres i god tid inden indgrebet.
Mænd med hypogonadotrop hypogonadisme har en god chance for at opnå brugbar spermatogenese ved behandling med gonadotropiner. Sæddeponering forud for start af testosteronbehandling bør dog også her overvejes. Hvis testosteronbehandling er iværksat, skal denne seponeres før behandlingen med gonadotropiner initieres. Det er en specialistopgave at styre gonadotropinbehandling.
Tilskud til behandling
Testosteronbehandling udløser ikke generelt tilskud. Ved indikation for behandling fremsendes anmodning om individuelt tilskud til Lægemiddelstyrelsen (www.fmk-online.dk). Symptomatologi, testosteron- og LH-niveauer skal anføres. Tilskudsbevilling gives til mænd med primær testosteronmangel (hypergonadotrop hypogonadisme).
Hvis indikationen for testosteronbehandling er sekundær testosteronmangel, skal den behandlende og kontrollerende hospitalsafdeling udlevere medicinen vederlagsfrit til patienten.
Referencer
- Wu FC, Tajar A, Beynon JM, Pye SR, Silman AJ, Finn JD, O’Neill TW, Bartfai G, Casanueva FF, Forti G, Giwercman A, Han TS, Kula K, Lean ME, Pendleton N, Punab M, Boonen S, Vanderschueren D, Labrie F, Huhtaniemi IT; EMAS Group. Identification of late-onset hypogonadism in middle-aged and elderly men. N Engl J Med. 2010;363(2):123-35.
- Corona G, Goulis DG, Huhtaniemi I, Zitzmann M, Toppari J, Forti G, Vanderschueren D, Wu FC. European Academy of Andrology (EAA) guidelines on investigation, treatment and monitoring of functional hypogonadism in males. 2020;8:970-987.
- Wiltink J, Beutel ME, Brahler E & Weidner W. Hypogonadism-related symptoms: development and evaluation of an empirically derived self-rating instrument (HRS ‘Hypogonadism Related Symptom Scale’). Andrologia 2009 41 297-304.
- Moore C, Huebler D, Zimmermann T, Heinemann LA, Saad F & Thai DM. The Aging Males’ Symptoms scale (AMS) as outcome measure for treatment of androgen deficiency. Eur Urol 2004 46 80-87.
- Tajar A, Huhtaniemi IT, O’Neill TW, Finn JD, Pye SR, Lee DM, Bartfai G, Boonen S, Casanueva FF, Forti G, Giwercman A, Han TS, Kula K, Labrie F, Lean ME, Pendleton N, Punab M, Vanderschueren D & Wu FC. Characteristics of androgen deficiency in late-onset hypogonadism: results from the European Male Aging Study (EMAS). J Clin Endocrinol.Metab 2012 97 1508-1516.
- Bhasin S, Woodhouse L, Casaburi R, Singh AB, Bhasin D, Berman N, Chen X, Yarasheski KE, Magliano L, Dzekov C, Dzekov J, Bross R, Phillips J, Sinha-Hikim I, Shen R & Storer TW. Testosterone dose-response relationships in healthy young men. Am J Physiol Endocrinol Metab 2001 281 E1172-1181.
- Gray PB, Singh AB, Woodhouse LJ, Storer TW, Casaburi R, Dzekov J, Dzekov C, Sinha-Hikim I & Bhasin S. Dose-dependent effects of testosterone on sexual function, mood, and visuospatial cognition in older men. J Clin Endocrinol Metab 2005 90 3838-3846.
- Bhasin S, Woodhouse L, Casaburi R, Singh AB, Mac RP, Lee M, Yarasheski KE, Sinha-Hikim I, Dzekov C, Dzekov J, Magliano L & Storer TW. Older men are as responsive as young men to the anabolic effects of graded doses of testosterone on the skeletal muscle. J Clin Endocrinol.Metab 2005 90 678-688.
- Bhasin S, Brito JP, Cunningham GR, Hayes FJ, Hodis HN, Matsumoto AM, Snyder PJ, Swerdloff RS, Wu FC, Yialamas MA. Testosterone Therapy in Men With Hypogonadism: An Endocrine Society Clinical Practice Guideline. J Clin Endocrinol Metab. 2018 May 1;103(5):1715-1744.
- Brambilla DJ, Matsumoto AM, Araujo AB, McKinlay JB. The effect of diurnal variation on clinical measurement of serum testosterone and other sex hormone levels in men. J Clin Endocrinol Metab. 2009 Mar;94(3):907-13.
- Chang S, Skakkebæk A, Trolle C, Bojesen A, Hertz JM, Cohen A, Hougaard DM, Wallentin M, Pedersen AD, Østergaard JR, Gravholt CH. Anthropometry in Klinefelter syndrome–multifactorial influences due to CAG length, testosterone treatment and possibly intrauterine hypogonadism. J Clin Endocrinol Metab. 2015 Mar;100(3):E508-17.
- Aksglaede L, Molgaard C, Skakkebaek NE, Juul A. Normal bone mineral content but unfavourable muscle/fat ratio in Klinefelter syndrome. Arch Dis Child. 2008 Jan;93(1):30-4.
- Gravholt CH, Chang S, Wallentin M, Fedder J, Moore P, Skakkebæk A. Klinefelter Syndrome: Integrating Genetics, Neuropsychology, and Endocrinology. Endocr Rev. 2018 Aug 1;39(4):389-423.
- Bang AK, Nordkap L, Almstrup K, Priskorn L, Petersen JH, Rajpert-De Meyts E, Andersson AM, Juul A & Jorgensen N. Dynamic GnRH and hCG testing: establishment of new diagnostic reference levels. Eur J Endocrinol 2017 176 379-391.
- Shankara-Narayana N, Yu C, Savkovic S, Desai R, Fennell C, Turner L, Jayadev V, Conway AJ, Kockx M, Ridley L, Kritharides L, Handelsman DJ. Rate and Extent of Recovery from Reproductive and Cardiac Dysfunction Due to Androgen Abuse in Men. J Clin Endocrinol Metab. 2020 Jun 1;105(6):dgz324.
- Windfeld-Mathiasen J, Dalhoff KP, Andersen JT, Klemp M, Horwitz A, Horwitz H. Male Fertility Before and After Androgen Abuse. J Clin Endocrinol Metab. 2021 Jan 23;106(2):442-449.
- Horwitz H, Andersen JT, Dalhoff KP. Health consequences of androgenic anabolic steroid use. J Intern Med. 2019 Mar;285(3):333-340.
- Pope HG Jr, Wood RI, Rogol A, Nyberg F, Bowers L, Bhasin S. Adverse health consequences of performance-enhancing drugs: an Endocrine Society scientific statement. Endocr Rev. 2014 Jun;35(3):341-75.
- Fernandez-Balsells MM, Murad MH, Lane M, Lampropulos JF, Albuquerque F, Mullan RJ, Agrwal N, Elamin MB, Gallegos-Orozco JF, Wang AT, Erwin PJ, Bhasin S & Montori VM. Clinical review 1: Adverse effects of testosterone therapy in adult men: a systematic review and meta-analysis. J Clin Endocrinol.Metab. 2010;95:2560-2575.
- Lincoff AM, Bhasin S, Flevaris P, Mitchell LM, Basaria S, Boden WE, Cunningham GR, Granger CB, Khera M, Thompson IM Jr, Wang Q, Wolski K, Davey D, Kalahasti V, Khan N, Miller MG, Snabes MC, Chan A, Dubcenco E, Li X, Yi T, Huang B, Pencina KM, Travison TG, Nissen SE; TRAVERSE Study Investigators. Cardiovascular Safety of Testosterone-Replacement Therapy. N Engl J Med. 2023 Jul 13;389(2):107-117.
- Dobs AS, Meike AW, Arver S, Sanders SW, Caramelli KE, Mazer NA. Pharmacokinetics, efficacy, and safety of a permeation-enhanced testosterone transdermal system in comparison with bi-weekly injections of testosterone enanthate for the treatment of hypogonadal men. J clin Endocrinol Metab. 1998;84:10.6078.
- Moisey R, Swinburne J, Orma S. Serum testosterone and bioavailable testosterone correlate with age and body size in hypogonadal men treated with testosterone undecanoate (1000 mg IM-Nebido). Clin Endocrinol. 2008;69:642-647.
- Abildgaard J, Petersen JH, Bang AK, Aksglaede L, Christiansen P, Juul A, Jørgensen N. Long-term testosterone undecanoate treatment in the elderly testosterone deficient male: An observational cohort study. Andrology. 2022 Feb;10(2):322-332.
- dmcg.dk/siteassets/kliniske-retningslinjer—skabeloner-og-vejledninger/kliniske-retningslinjer-opdelt-pa-dmcg/daproca/daproca_opsporing-og-diagnostisk-udredning-af-prostatacancer_v.1.0_admgodk_12012023.pdf
Tovholder
Øvrige forfattere
Christoffer Krogager
Claus H. Gravholt
Jon Rasmussen
Lars Folkestad
Lene Ring Madsen
Liva Bundgaard Larsen
Malin Sofia Desirée Nilsson
Marie Juul Ørnstrup
Niels Jørgensen
Simone Bjerregård Sneppen
Torben Leo Nielsen
Seneste revision: Oktober 2023
Næste revision: Oktober 2026