Hvad omfatter denne NBV
Gynækomasti hos mænd > 18 år, både uni- og bilateral.
Hvad omfatter denne NBV ikke
Hypertrophia areolae mammae (diagnosekode DN629B).
Dobbeltsidig mammahypertrofi (diagnosekode DN629D).
Enkeltsidig mammahypertrofi (diagnosekode DN629E).
Lipomasti – ofte kaldet pseudogynækomasti – er ikke gynækomasti men en tilstand med øget fedtvæv uden udvikling af glandelvæv. Lipomasti klassificeres under diagnosekoderne enkelt- eller dobbeltsidig mammahypertrofi (DN629D eller DN629E).
Brystkræft/Mammacancer (DC50 og undergrupper af denne hoveddiagnose).
Behandling af gynækomasti opstået som følge af behandling af prostatacancer.
Diagnosekoder
Gynækomasti, DN629A.
Definition
Gynækomasti er en benign proliferation af brystkirtelvævet hos mænd.
Gynækomasti er ikke en præ-malign tilstand.
Forekomst
Neonatal gynækomasti opstår hos op mod 90% af drenge de første uger efter fødslen pga. hormonel påvirkning fra det intrauterine miljø. Neonatal gynækomasti kan også opstå i 2.-3. levemåned pga. ”minipuberteten”. Neonatal gynækomasti betragtes generelt som et fysiologisk fænomen, der typisk svinder spontant i løbet af få uger.
Pubertal gynækomasti udvikles hos mere end halvdelen af drenge, typisk midt i puberteten men forsvinder hos de fleste i løbet af 6-24 måneder1. Gynækomastien persisterer dog hos få procent2. Nogle drenge kan have intermitterende gynækomasti.
Gynækomasti hos voksne mænd rapporteres med varierende frekvenser; i kliniske studier 30-65%, i autopsistudier 40-55%3. I et retrospektivt tværsnitsstudie af CT-scanninger på anden indikation havde 25% subareolært kirtelvæv >2 cm i diameter4. Det normale er, at der ikke er påviseligt kirtelvæv. Hos op til knap 50% af patienterne findes gynækomastien unilateralt.
Ætiologi
Brystkirtelvæv indeholder androgen- og østrogenreceptorer foruden andre receptorer (Figur 1). Østrogener stimulerer kirtelvækst, mens androgener hæmmer væksten.
Figur 1 (Narula and Carlson, Nat Rev Endocrinol 2014).
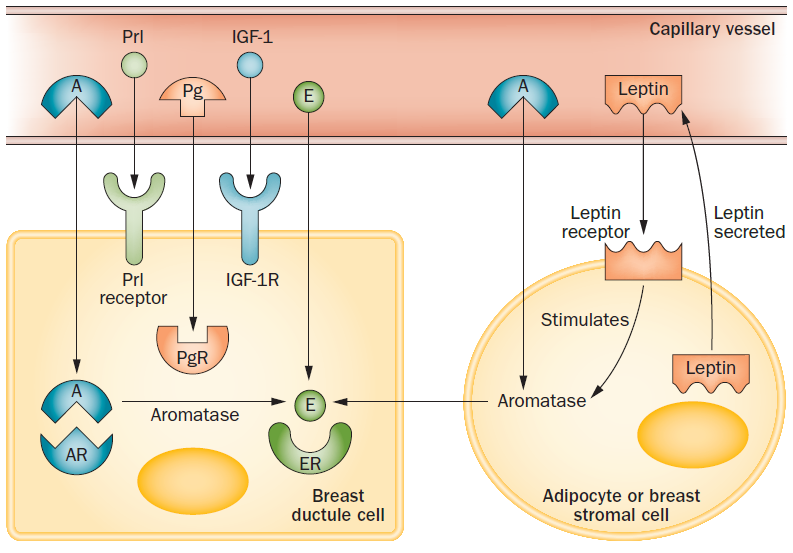
A: Androgen. E: Østradiol. IGF-1: Insulin-lignende faktor 1. Pg: Progesteron. Prl: Prolaktin. R: Receptor (f.eks. AR: androgen receptor).
Gynækomasti skyldes en øget ”østrogen-testosteron-ratio” pga. et relativt østrogen-overskud eller en relativ testosteron-mangel. Hos nogle patienter kan der måles nedsatte serumværdier af testosteron eller forhøjede østrogenniveauer, men oftere drejer det sig om diskrete, relative forskydninger, som ikke bringer de målte niveauer af kønshormon uden for normalområdet. I sjældne tilfælde findes højt eller forhøjet serum testosteron men reduceret testosteron-effekt pga. nedsat receptorfølsomhed.
Der er mange årsager til, at østrogen-testosteron-balancen kan forskydes, men overordnet set er de endokrinologiske mekanismer ufuldstændigt klarlagt.
Testosteron, det primære androgen hos manden, dannes i testiklerne (>95%) og binyrerne (<5%). Alle tilstande, som reducerer testosteronproduktionen kan resultere i ændret østrogen-testosteron-ratio. Testosteron omdannes ved aromatisering (i gonader, fedtvæv og brystvæv) til østradiol, mens en mindre del reduceres via enzymet 5α-reduktase til dihydrotestosteron (DHT). Aromatase-aktiviteten øges af luteiniserende hormon (LH) og alkohol, og er også øget ved adipositas. Det resulterer i, at en relativt øget del af testosteron omdannes til østradiol fremfor DHT, og østrogen-testosteron-ratioen øges. Et (relativt) øget østrogenniveau vil ydermere øge mængden af sexhormonbindende globulin (SHBG), hvilket reducerer koncentrationen af biologisk aktivt frit testosteron yderligere.
Tabel 1 summerer de underliggende årsager til gynækomasti. Generelt kan der påvises en årsag til gynækomastien hos cirka halvdelen af de mænd, som udredes5. Specielt hos ældre er der ofte flere samtidige årsager.

Tabel 2 summerer medicintyper, der menes at kunne give gynækomasti. Listen er opdateret i forbindelse med udarbejdelse af den aktuelle version af NBV’en. Listen er formentlig ikke udtømmende og må løbende opdateres i forbindelse med revisioner af NBV’en.
| Tabel 2: Medicintyper, der menes at kunne give gynækomasti | |||
| ATC grupper | Stofklasser | Præparater | |
| A. Fordøjelses systemet | |||
| Syrepumpehæmmere | PPI | Omeprazol | A02B |
| Esomeprazol | A02B | ||
| H2 blokker | Cimetidin | A02B | |
| Ranitidin | A02B | ||
| Antiemetika | Metclopramid | A03F | |
| Domperidon | A03F | ||
| Centralstimulerende anorexikum | Amfepramon | A08A | |
| B. Blod og bloddannelse | |||
| Clopidogrel | B01A | ||
| C. Kardiovaskulære system | |||
| Hjertemedicin | Digoxin | C01A | |
| Amiodaron | C01B | ||
| Antihypertensivae | Imidazolin receptor agonist | Clonidin | C02A |
| Alfa receptor blokker | Methyldopa | C02A | |
| Doxazosin | C02C | ||
| Loop diuretika | Bumetanid | C03C | |
| Aldosteron agonister | Spironolacton | C03D | |
| Eplerenon | C03D | ||
| Natrium kanal blokker | Amilorid | C03E | |
| Calcium antagonister | Amlodipin | C08 | |
| Dilthiazem | C08 | ||
| Felodipin | C08 | ||
| Nifedipin | C08 | ||
| Verapamil | C08 | ||
| ACE hæmmere | Captopril | C09 | |
| Enalapril | C09 | ||
| Lisinopril | C09 | ||
| Perindopril | C09 | ||
| Ramipril | C09 | ||
| Trandolapril | C09 | ||
| Lipidsænkende | Statiner | Atorvastatin | C10A |
| Fluvastatin | C10A | ||
| Pravastatin | C10A | ||
| Rosuvastatin | C10A | ||
| Simvastatim | C10A | ||
| Fibrater | C10A | ||
| G. Kønshormoner og modulatorer af genitalsystemet | |||
| Testosteroner | G03B | ||
| Østrogener | G03C | ||
| Østrogenreceptorantagonister | Clomifen | G03G | |
| Gonadotropin(effekter) | Choriongonadotropin | G03G | |
| Follitropin alfa | G03G | ||
| Follitropin beta | G03G | ||
| Follitropin delta | G03G | ||
| Antiandrogener | Cyproteron Acetate | G03H | |
| 5-alfa reduktasehæmmere | Dutasteride | G04C | |
| Finasteride | G04C | ||
| Tamsolusin | G04C | ||
| H. Systemiske hormoner eks kønshormoner | |||
| Væksthormon | Somatropin | H01A | |
| IGF-1 | Mecasermin | H01A | |
| J. Midler mod infektionssygdomme | |||
| Antibakterielle | Metronidazol | J01X | |
| Antimycotica | Itraconazol | J02A | |
| Steroid syntese hæmmer | Ketokonazol | J02A | |
| Tuberkulosemidler | Etionamid | J04A | |
| Isoniazid | J04A | ||
| Antivirale midler | HAART* | Lamivudin | J05A |
| Zidovudin | J05A | ||
| Efavirenz | J05A | ||
| L01 Antineoplastiske og immunmodulerende stoffer | |||
| Alkylerende stoffer | Carmustine | L01A | |
| Folsyre antagonister | Metotrexate | L01B | |
| Vinca alkaloider | Vincristin | L01C | |
| Antineoplastisk | Mitotane | L01X | |
| Procarbazine | L01X | ||
| Mab’er | Imatinib | L01E | |
| Dasatinib | L01X | ||
| L02 Endokrin terapi | |||
| GnRH analoger | Leuprorelin | L02A | |
| Goserelin | L02A | ||
| Histrelin | L02A | ||
| Triptorelin | L02A | ||
| Antiandrogener | Bicalutamid | L02B | |
| Flutamid | L02B | ||
| Degarelix | L02B | ||
| L04 Immunsuppresivae | |||
| Immunsuppresiva | Ciclosporin | L04A | |
| Cladribin | L04A | ||
| Thalidomid | L04A | ||
| N Nervesystemet | |||
| Analgetika | Opioider | Methadone | N07B |
| Antiepileptika | Phenytoin | N03A | |
| Gabapentin | N03A | ||
| Antipsykotika | Risperidon | N05A | |
| Haloperidol/ Serenase | N05A | ||
| Perphrenazin | N05A | ||
| (Chlor) Promazine | N05A | ||
| Sedativae | Alprazolam | N05B | |
| Diazepam | N05B | ||
| Zopiclone | N05C | ||
| Melatonin | N05C | ||
| Antidepressivae | Tricyklisk | Imipramin | N06A |
| Nortriptylin | N06A | ||
| SSRI | Sertraline | N06A | |
| ADHD / CNS stimulerende | Methylphenidat | N06B | |
| R. Respirations systemet | |||
| Astmamidler | Theophylline | ||
| Misbrugs substanser | |||
| Anabole steroider | Nandrolone | ||
| Fluoxymesterone | |||
| Oxymetholone | |||
| Stanozolol | |||
| Og mange andre | |||
| Cannabis | Hash, mariuana | ||
| Opioider | Heroin | ||
| Metadon | |||
| CNS stimulerende | Amfetamin | ||
| Alkohol | |||
| Duftstoffer i cremer og olier | Lavendel olie | ||
| Tee tree olie | |||
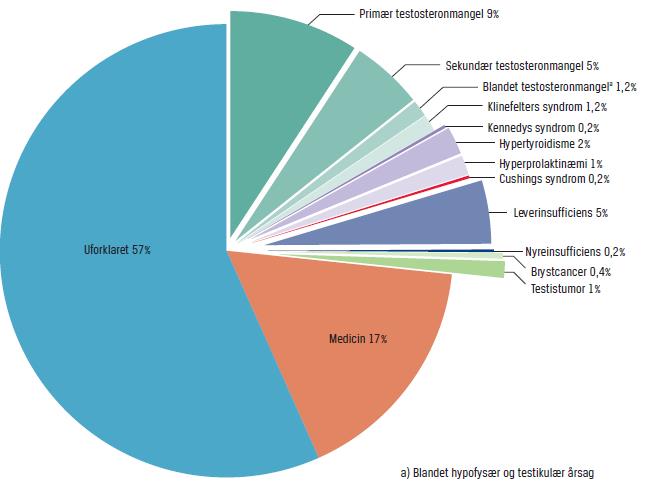
Figur 2 viser fordelingen af underliggende årsager til gynækomasti hos voksne danske mænd, der ikke har misbrug af anabole steroider eller er i igangværende antiandrogen behandling. Hos ca. 15% fandtes mere end en årsag (dvs. mere end en årsag hos lidt over en fjerdedel af patienterne, hvor der kunne påvises en årsag).
Figur 2 (tilpasset fra Mieritz et al, EJE 2017).
I det følgende beskrives kort kliniske tilstande, der kan lede til gynækomasti. Her er rækkefølgen kategoriseret efter den væsentligste endokrine forstyrrelse.
Reduceret androgen koncentration:
Testosteronmangel(for udredning og behandling af testosteronmangel, se særskilt NBV)
– Primær testosteronmangel ses ved tilstande med reduceret Leydigcellefunktion karakteriseret ved nedsat eller lav normal serum testosteron. Det øgede LH-niveau medfører øget aromataseaktivitet og dermed øgning af østrogen-testosteronratioen.
– Sekundær testosteronmangel ses ved tilstande, som hæmmer sekretionen af gonadotropin-releasing-hormone (GnRH) fra hypothalamus eller hypofysens sekretion af luteiniserende hormon (LH) eller en kombination heraf.
Hyperprolaktinæmi
Hyperprolaktinæmi af alle årsager (hypofyseadenomer, stilk-effekt, nyresygdom, medikamentelt udløst) hæmmer sekretionen af GnRH fra hypothalamus og derved hele hypothalamus-hypofyse-testisaksen.
Nyresygdom
Nyreinsufficiens forårsager både gonadal -og hypothalamisk-hypofysær dysfunktion per se og yderligere ses ofte ledsagende hyperprolaktinæmi.
Kombination af høj østrogen- og androgenkoncentration:
Kennedy Syndrom (X-bundet spinal og bulbær muskelatrofi)
Genetisk, sjældent syndrom (1:40.000 mænd), hvor androgen-receptorens testosteron-sensitivitet er nedsat i mild grad. Symptomer ses hyppigst først i 40-50-årsalderen med neuro-muskulære symptomer som fascikulationer, muskelsvaghed -og atrofi samt kliniske tegn til testosteronmangel heriblandt gynækomasti.
Androgen insensitivitet syndrom
Sjældent syndrom (1:20.000 mænd), hvor mutation i genet for androgenreceptoren medfører nedsat receptorsensitivitet. Ved komplet androgen insensitivitet (complete androgen insensitivity syndrome, CAIS) er patienterne fænotypisk kvinder. Ved partiel insensitivitet (partiel androgen insensitivity syndrome, PAIS) er patienterne ofte fænotypisk mænd med nedsat virilisering i varierende grad. Gynækomasti udvikles hos de fleste i pubertetsårene og persisterer eller forværres i voksenlivet.
Hyperthyroidisme og hypothyroidisme
Prævalensen af gynækomasti er beskrevet som ca. 40% hos mænd med hyperthyroidisme. De perifere thyroideahormoner øger SHBG, hvorved koncentrationen af frit (biologisk aktivt) testosteron falder. Kompensatorisk stiger LH for at opretholde en sufficient koncentration af frit testosteron. LH stimulerer dog samtidig aromatase-enzymet, hvorved der dannes mere østradiol, og østrogen-testosteron-rationen øges. Gynækomasti er også beskrevet som ledsagesymptom ved myxødem omend formentlig ikke et hyppigt fænomen. Mekanismen herfor er ikke klarlagt.
Leydig- og Sertolicelletumores
Benigne testis tumorer (påvises hos ca. 1:100 mænd med gynækomasti), som kan secernere store mængder af testosteron og østradiol.
Testikelcancer
Germinalcelletumorer, som indeholder choriocarcinomkomponenter, secernerer hCG som stimulerer Leydigcellerne til øget testosteronproduktion. Samtidig øges aromataseaktiviteten og østrogen-testosteron-rationen øges.
Misbrug af anabole steroider
Misbrug af anabole steroider leder meget ofte til gynækomasti. Undersøgelser har vist indhold af ikke-deklareret anabolt steroid i 15% af de kosttilskud/proteinpulvere, man undersøgte. Yderligere misbruges ofte andre hormoner samtidig med anabole steroider, f.eks. hCG, væksthormon og binyrebarkhormon, som også kan lede til udvikling af gynækomasti.
Høje østrogenkoncentrationer:
Cannabis
Det er ikke velbeskrevet, hvor ofte cannabis-misbrug leder til gynækomasti. Mekanismen er ikke fuldt klarlagt men involverer formentlig hyperprolaktinæmi, en grad af sekundær testosteronmangel foruden at molekylet cannabinoid, som er den aktive komponent i marihuana, strukturelt ligner østradiol. Der findes aktuelt (efterår 2019) ikke undersøgelser af en eventuel sammenhæng mellem anvendelse af cannabidiolpræparater og udvikling af gynækomasti.
Adipositas
Fedtceller indeholder aromatase, som konverterer testosteron til østrogen og derved opnås en relativt øget mængde af østrogen hos adipøse individer. Hos adipøse individer kan det være svært at skelne mellem egentlig gynækomasti og lipomasti.
Leversygdom
Gynækomasti ses hyppigt ved levercirrose, formentlig pga. øget SHBG-koncentration, der fører til et lavere frit-testosteron niveau. Desuden kan nogle af de præparater, der anvendes ved levercirrose, f.eks. Spironolacton, medføre gynækomasti.
Alkohol
Kronisk alkoholmisbrug påvirker direkte Leydigcellernes funktion negativt og er dermed associeret med primær testosteronmangel. Alkoholbetinget leversygdom kan desuden være en medvirkende faktor.
Aromatase excess syndrom
Ekstremt sjældent genetisk syndrom karakteriseret ved en overekspression af aromataseenzymet, hvilket medfører høje østrogenniveauer.
Medicin
Medikamina kan forårsage gynækomasti (Tabel 2). Mekanismerne herfor er ofte dårligt beskrevet, og ofte er det svært at afklare om gynækomastien skyldes farmaka, grundsygdommen eller testosteronmangel relateret til svær sygdom.
Svær akut eller kronisk sygdom, inkl. re-feeding syndrome
Non-gonadale tumorer:
Binyretumorer
Binyrecarcinomer (0.5-2.0 per million) kan secernere store mængder androgener, som kan aromatiseres til østrogen.
Akromegali
Pubertetsdrenge med gynækomasti er i et studie fundet at have højere IGF-1 end drenge uden gynækomasti. Hos voksne er der ikke en oplagt sammenhæng mellem gynækomasti og IGF-1 niveauer og undersøgelse af dette hører ikke til i den primære udredning.
Prostatacancer
Mænd i androgendepriverende behandling mod prostatacancer udvikler gynækomasti, hvis der ikke forud for behandlingen er givet strålebehandling mod mammae eller hvis de ikke modtager aromatasehæmmer eller lignende.
Symptomer og kliniske fund
Patienterne har ofte følt en knude (uni- eller bilateralt) af varierende størrelse under brystvorten, som kan være øm. Ømhed er udtryk for en fortsat stimulation af kirtelvævet. Ofte er det frygt for kræft der gør, at patienterne opsøger læge. Brystcancer hos mænd er sjælden (ca. 35 tilfælde årligt i Danmark), og optræder stort set aldrig hos personer under 35 år. Gynækomasti er ikke en præmalign tilstand, hvilket også gælder den unilateralt forekommende gynækomasti. Særlig opmærksomhed er dog påkrævet hos mænd med Klinefelters syndrom eller BRCA2-mutation, hvor risikoen for udvikling af brystkræft er 50-100 gange større end i baggrundsbefolkningen.
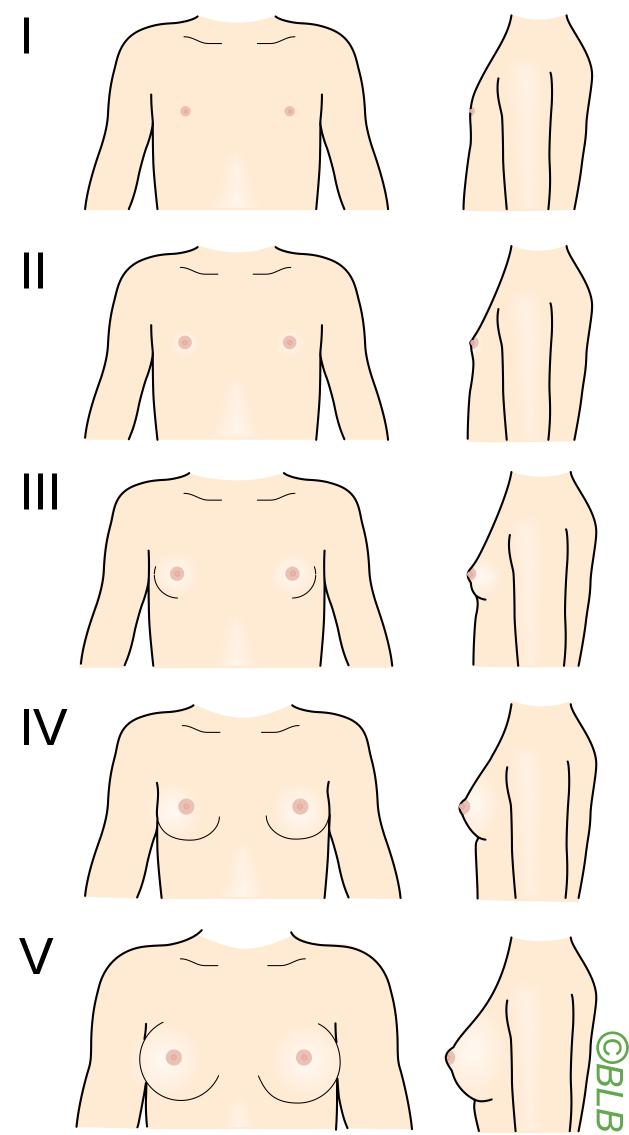
Graden af gynækomasti beskrives vha. Tannerskalaen (Figur 3), hvor Tanner 1 svarer til det normale maskuline bryst, mens Tanner 5 svarer til et fuldt udviklet kvindebryst. Gynækomasti er ved palpation fast og elastisk og adskiller sig fra lipomasti, der udelukkende består af fedtvæv, ved at der kan palperes kirtelvæv subareolært. Hos udtalt adipøse mænd kan gynækomasti være svær at skelne fra lipomasti, og ultralydundersøgelse kan være relevant. Brystkræft palperes som en hård og til tider perifert beliggende tumor, der kan være fastsiddende med indtrækning af huden. Ulceration og/eller blodig sekretion fra papillen kan også forekomme ved brystkræft. Ved mistanke om cancer henvises patienten straks til kræftpakkeforløb efter lokale retningslinjer.
Figur 3. Tanner stadier af brystudvikling.
Udredning
Ved den initiale undersøgelse, som typisk foregår hos alment praktiserende læge, bør lipomasti, oplagt mammacancer eller testiscancer udelukkes. Ved mistanke om kræft skal egen læge henvise til kræftudredningsforløb efter lokale retningslinjer.
Gynækomasti under puberteten uden ledsagende testistumor eller mistanke om anden systemisk årsag kan ses an med kontrol.
Gynækomasti opstået hos voksne (> 18 år) skal henvises til en endokrinologisk afdeling med henblik på udredning. Dog undtages gynækomasti opstået i forbindelse med hormonmanipulation, f.eks. som led i behandling af prostatacancer eller ved misbrug af anabole steroider.
Udredning omfatter anamnese, objektiv undersøgelse, biokemiske undersøgelser og eventuel billeddiagnostik (se Figur 4 og nedenfor).
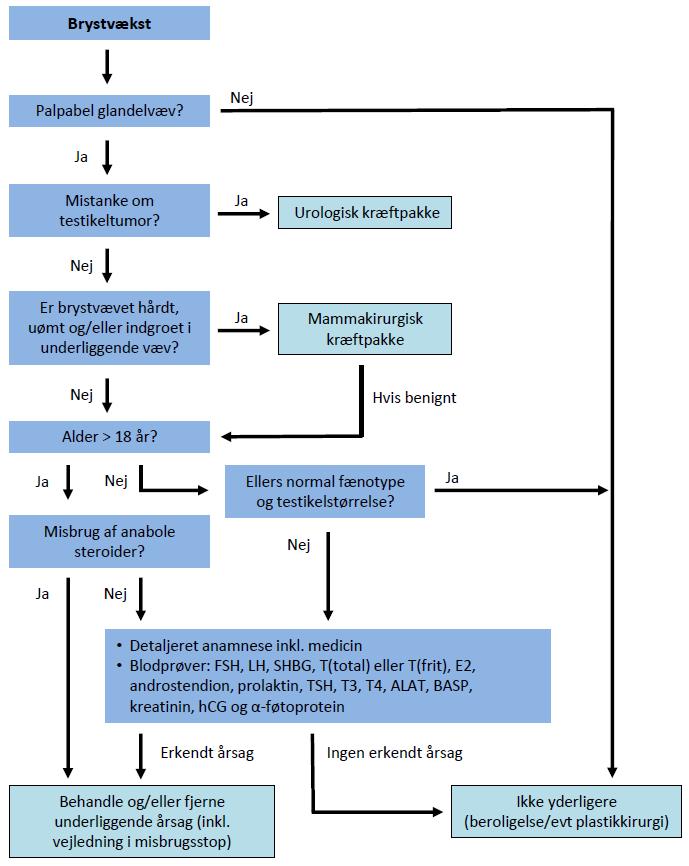
Figur 4: Flow-chart for udredning af gynækomasti (tilpasset fra Mieritz et al, EJE 2017).
Figur 4, forkortelser:
FSH: Follikelstimulerende hormon
LH: Luteiniserende hormon
SHBG: Sexualhormon-bindende globulin
T: Testosteron
E2: Østradiol
TSH: Thyroideastimulerende hormon
T3: Triiodthyronin
T4: Thyroxin
ALAT: Alanin aminotransferase
BASP: Basisk fosfatase
hCG: humant chorion gonadotropin
Anamnese
- Tidligere og nuværende sygdomme
- Debuttidspunkt og varighed af gynækomasti
- Hastighed i udviklingen
- Tidligere tilstedeværelse af gynækomasti Andrologisk anamnese (kryptorkisme, tidspunkt for pubertet, fertilitetsstatus, symptomer på testosteronmangel inkl. seksuel funktion [se særskilt NBV])
- Afdækning af symptomer på andre potentielle underliggende årsager (se under ætiologi)
- Medicingennemgang med speciel fokus på præparater nævnt i Tabel 2
- Direkte forespørgsel til rusmidler og anabole steroider (se under ætiologi)
Objektiv undersøgelse
- Inspektion og palpation af mammae inkl. aksiller.
- Dokumentere gynækomastien;
- størrelse (Tannerskala, Figur 3)
- konsistens
- uni- eller bilateral
- eventuel galaktoré
- Vurdering af eventuelle tegn til thyreoidea-associeret sygdom, lever- nyresygdom eller Cushings syndrom.
- Vurdering af graden af maskulinisering, herunder;
- virilisering (kønsbehåring, skægvækst, kropsbehåring)
- muskelfylde og kropsproportioner (maskuline, feminine, eunukoide)
- eventuelle tegn på misbrug af anabole steroider (øget muskelmasse, akne, striae)
- Vurdering af genitalia eksterna;
- pubesbehåring, penis, testes palpation mhp størrelse (vha. orkidometer) og fund af tumores
- hvis der ikke findes oplagt årsag til gynækomastien og ”østrogen-testosteron-ratioen” samtidigt ikke er oplagt normal foreslås det at udføre UL af testes. Små og sædvanligvise benigne testistumores som Leydigcelletumorer eller Sertolicelletumorer (der begge kan forårsage gynækomasti) kan være ikke-palpable. De forekommer hos under 1% af patienter med gynækomasti, hvorfor rutinemæssig UL af testes ikke nødvendigvis skal udføres på alle, der udredes for gynækomasti
- ved fund af testistumor henvises patienten til kræftpakkeforløb efter lokale retningslinjer
- Antropometriske data (højde, vægt, BMI)
Biokemisk udredning
- Blodprøver bør tages morgen/formiddag og ikke under akut sygdom. Ved abnorme resultater anbefales at tage yderligere et sæt blodprøver.
- LH, FSH, testosteron (total) eller testosteron (frit), østradiol, SHBG, androstendion, prolaktin, TSH, T3, T4, ALAT, basisk fosfatase, kreatinin og hCG og α-føtoprotein (for at afsløre eventuel testikel- eller ekstragonadal- kræft).
Fortolkning af kønshormonprofil
I nogle situationer er kønshormonprofilen oplagt abnorm. Det kan dog også dreje sig om diskrete, relative forskydninger, som ikke bringer de målte niveauer af kønshormon uden for normalområdet. Således kan et testosteron lavt i normalområdet kombineret med et østradiol højt i normalområdet være udtryk for øget østrogen/testosteron – selvom de enkeltvis ligger indenfor referenceområdet5.
Behandling
Behandling af gynækomasti afhænger af den udløsende årsag og muligheden for håndtering af denne. Medikamentelt udløst gynækomasti svinder ofte i løbet af måneder efter seponering af udløsende agens.
De fleste mænd med nyopstået gynækomasti, hvor man ikke kan påvise nogen underliggende årsag, vil opleve spontan regression af gynækomastien inden for 6-12 måneder.
Medicinsk behandling
Mænd, hvor gynækomasti er udløst af testosteronmangel, bør tilbydes testosteronsubstitution. Ømhed og evt. progression af gynækomastien vil ophøre og omfanget af gynækomastien evt. aftage. Testosteronbehandling har ingen plads i behandling af gynækomasti hos eugonade mænd, hvor det vil kunne forværre gynækomasti. Der er ikke evidens for at behandle med f.eks. ikke-aromatiserbare testosteroner (f.eks. dihydrotestosteron), anti-østrogener (SERM) eller aromatasehæmmere til mænd med idiopatisk gynækomasti.
Kirurgisk behandling
Kun et fåtal af mænd med gynækomasti vil kunne tilbydes kirurgisk behandling i offentligt regi. Henvisning til plastikkirurgisk vurdering og behandling bør først ske efter en passende observationsperiode (>12 mdr.). Patienter med persisterende gynækomasti Tanner stadium 4-5 og ønske om korrektion kan henvises til vurdering i offentligt regi. Mænd med unilateral gynækomasti Tanner stadium 3 kan også henvises til vurdering idet dette stadie opfattes som en ”grå-zone” og inddeling i Tanner stadier ikke altid beskriver funktionelle gener. Tilbud om korrektion vil være baseret på en individuel vurdering. Overvægt og aktiv rygning øger risikoen for komplikationer ved kirurgisk korrektion, hvorfor patienten på henvisningstidspunktet skal være normalvægtig (BMI ≤ 25) og ophørt med tobaksforbrug i mindst 6 uger. I erkendelse af at BMI som parameter for overvægt er mindre sikker ved blandt andet høje mænd og ældre kan der foretages en individuel vurdering.
Kirurgisk korrektion af gynækomasti kan bestå i kirurgisk ekstirpation via periareolær adgang, kirurgisk fjernelse af både kirtelvæv og hud som reduktionsplastik eller simpel mastektomi med fri flytning af areolapapilkompleks. Kirurgisk korrektion kan eventuelt kombineres med liposuction.
De fleste privathospitaler og private plastikkirurgiske klinikker tilbyder kirurgisk behandling på kosmetisk indikation, herunder også patienter med lave Tanner stadier (2-3). Hos yngre patienter tilrådes det også i privat regi, at tilstanden ses an i en passende periode før kirurgisk korrektion tilbydes.
(Ovenstående afsnit om kirurgisk behandling er udarbejdet efter råd fra formanden for Dansk Selskab for Plastik- og Rekonstruktionskirurgi).
Prognose
Gynækomasti opstået i nyfødthedsperioden og pubertetsårene vil i langt de fleste tilfælde forsvinde af sig selv indenfor 6-24 måneder. Prognosen i forhold til udbredning og smerte afhænger primært af, om årsagen kan behandles. Behandles den tilgrundliggende årsag, vil smerterne aftage. Reduktion i gynækomastiens størrelse vil være størst ved tidlig start. Gynækomasti, der har varet mere end 1 år, har øget tendens til delvis fibrøs omdannelse når stimulationen af glandelvævet ophører.
Visitation
Patienter med gynækomasti henvises til udredning på endokrinologiske afdelinger. Eventuel vurdering i plastikkirurgisk regi bør være forudgået af endokrinologisk udredning. Ved mistanke om brystkræft henvises til kræftpakkeforløb.
Det er væsentligt, at mænd, hvor der er én umiddelbar årsag til gynækomastiens opståen (f.eks. nylig opstart af medicinsk præparat) også bør henvises til udredning. Der findes ofte mere end én årsag til gynækomastien, hvor den anden årsag ikke har manifesteret sig alene (f.eks. testosteronmangel).
Opfølgning
Patienter, hvor der påvises underliggende årsag til gynækomastien skal følges op, afhængigt af behandlingen af årsagerne.
Mænd, som er kosmetisk generet af gynækomasti efter mere end 12 måneders observationspe-riode, kan henvises til kirurgisk vurdering (se Kirurgisk behandling).
Referenceliste
- Mieritz MG, Raket LL, Hagen CP, Nielsen JE, Talman ML, Petersen JH et al. A Longitudinal Study of Growth, Sex Steroids, and IGF-1 in Boys With Physiological Gynecomastia. J Clin Endocrinol Metab 2015; 100(10):3752-3759.
- Priskorn L, Nordkap L, Bang AK, Krause M, Holmboe SA, Egeberg Palme DL et al. Average sperm count remains unchanged despite reduction in maternal smoking: results from a large cross-sectional study with annual investigations over 21 years. Hum Reprod 2018; 33(6):998-1008.
- Kanakis GA, Nordkap L, Bang AK, Calogero AE, Bartfai G, Corona G et al. EAA clinical practice guidelines-gynecomastia evaluation and management. Andrology 2019.
- Gossner J. Gynecomastia on Computed Tomography of The Chest -Prevalence in A Clinical Population and An Analysis of Possible Causes. Eur J Breast Health 2019; 15(1):67-68.
- Mieritz MG, Christiansen P, Jensen MB, Joensen UN, Nordkap L, Olesen IA et al. Gynaecomastia in 786 adult men: clinical and biochemical findings. Eur J Endocrinol 2017; 176(5):555-566.
- Sollie M. Management of gynecomastia-changes in psychological aspects after surgery-a systematic review. Gland Surg 2018; 7(Suppl 1):S70-S76.
Tovholder
Øvrige forfattere
Loa Nordkap
Simone Bjerregård Sneppen
Hanne Mumm
Mikkel Andreassen
Marie Juul Ørnstrup
1. udgave:2019
Revideret: 2022
Næste revision: 2025
