Hvad omfatter denne NBV
Udredning og behandling af type 2 diabetes samt steroidinduceret diabetes.
Hvad omfatter denne NBV ikke
Type 1 diabetes, monogenetisk diabetes, ketoacidose og hyperosmolært koma, diabetes og kirurgi, diabetes og graviditet samt diabetes med neurologiske senfølger samt fodproblemer (se øvrige NBV’er)
Diagnosekoder (ICD)
E11.2 Type 2-diabetes med nyrekomplikation
E11.3 Type 2-diabetes med øjenkomplikation
E11.4 Type 2-diabetes med neurologisk komplikation
E11.5 Type 2-diabetes med komplikationer i perifere karsystem
E11.6 Type 2-diabetes med anden (makrovaskulær) komplikation
E11.7 Type 2-diabetes med multiple komplikationer
E11.8 Type 2-diabetes med komplikation UNS
E11.9 Type 2-diabetes uden komplikationer
E.13.2-9 Steroidinduceret diabetes
Definition
Type 2-diabetes (T2DM) spænder fra insulinresistens med relativ insulin mangel til overvejende insulin mangel. Er karakteriseret ved fravær af cirkulerende antistoffer mod ß-celle antigener, ofte debutalder over 40 år og er associeret med overvægt og inaktivitet.
- Sikker adskillelse fra type 1 diabetes, LADA (Latent Autoimmune Diabetes in Adults) fordrer måling af C-peptid og GAD-antistof.
- Kronisk pancreatitis og pancreascancer taler for sekundær diabetes.
- Familiært ophobede tilfælde af klinisk type 2 diabetes hos unge skal give mistanke om monogen diabetes, MODY (Maturity Onset of Diabetes in the Young) og genetisk diagnostik overvejes.
Forekomst
Ifølge Register for Udvalgte Kroniske Sygdomme (RUKS) var der ca. 241.000 patienter med type 2 diabetes i Danmark i 2018, og dertil et antal patienter diætbehandlede patienter, som ikke opfanges af RUKS. Der er således ca. 300.000 patienter med T2DM samt et ukendt antal personer med ikke-erkendt sygdom, ca. 60.000. Et stort antal personer har desuden HbA1c højt i normalområdet (42-47 mmol/mol) og meget høj risiko for at udvikle T2DM.
Ætiologi
Genetisk disposition er vigtig, men livsstil med mangel på fysisk aktivitet, uhensigtsmæssig kost og overvægt er af helt afgørende betydning. Andre faktorer som f.eks. lav fødselsvægt hos børn født til terminen disponerer også til T2DM.
Sygdommen er heterogen i udtryk og patogenese med én eller flere dominerende faktorer: perifer insulinresistens, øget hepatisk glukoseproduktion, nedsat betacelle funktion, nedsat inkretin-respons på fødeindtagelse og øget lipolyse i de abdominale fedtceller.
Symptomer og kliniske fund
Diagnosen stilles ofte tilfældigt ved screening af patienter med hypertension, iskæmisk storkarsygdom eller adipositas, eller tegn til følgetilstande til diabetes som f.eks. synsforstyrrelser, neuropatisymptomer, træthed, polyuri, tørst og infektioner.
Udredning
Diagnosen diabetes kan stilles på følgende måder:
- Påvisning af hæmoglobin A1c ≥ 48 mmol/mol (tidligere 6,5 %).
HbA1c kan ikke anvendes til sikker diabetesdiagnostik hos patienter med kronisk nyreinsufficiens, hæmoglobinopatier, nylig transfusion eller hæmatologiske sygdomme, der påvirker erythrocytlevetiden. I disse tilfælde screenes med: - Påvisning af (fastende eller ikke fastende) venøs plasmaglukose ≥11,1 mmol/l og klassiske symptomer (polyuri, polydipsi, uforklaret vægttab eller gentagne infektioner)
- Påvisning af faste venøs plasmaglukose ≥ 7,0 mmol/l eller 2-timers venøs plasmaglukose ≥ 11,1 mmol/l efter peroral glukosebelastning (OGTT).
Tilfældigt fund af forhøjet HbA1c eller forhøjede blodsukkerværdier uden symptomer på diabetes, bør resultere i gentagen måling af henholdsvis HbA1c og blodsukre for at bekræfte diagnosen.
Prognose
Den aldersspecifikke mortalitetsrate i den danske type-2 diabetes population stiger med alderen. Ved alder 65 år, der typisk svarer til gennemsnitsalderen i de kliniske studier er mortalitetsraten omkring 2 per 100 patientår. For personer i alderen 50 til 75 år afkortede type-2 diabetes i 2017 den gennemsnitlige levetid med hhv. 6 og 2 år, idet antal tabte leveår er omvendt proportionalt med alder. Overordnet er dødeligheden ved T2DM dog faldet med 3%/år og overdødeligheden i forhold til baggrundsbefolkningen uden diabetes er faldet ca. 0,7%/år fra 2006 til 2017.
Selvom incidensen af de fleste akutte og kroniske diabeteskomplikationer har været faldende fra
2006 til 2017, har det parallelle fald i dødelighed betydet at prævalensen af visse komplikationer har
været stigende, fordi personer med diabetes lever længere med komplikationer. Samtidig betyder den
store stigning i prævalensen af T2DM, at et meget stort antal personer lever med kroniske komplikationer.
Dette er især tilfældet for hjertekarsygdom (CVD) som findes hos > 100.000 personer med
T2D, diabetisk nyresygdom (CKD) og moderat-svær retinopati, som hver findes hos ca. ∼40.000
personer med T2DM.
Kilde: Marit Eika Jørgensen, Hanan Amadid and Bendix Carstensen; SDCC 2020: Diabetes demography, cardiometabolic risk factors, and acute- and chronic diabetes complications in a nationwide diabetes registry in Denmark.
Behandling
Disse retningslinjer for den farmakologiske behandling af type 2-diabetes (T2DM) er resultatet af et samarbejde mellem Dansk Endokrinologisk Selskab (DES) og Dansk Selskab for Almen Medicin (DSAM). Det er 3. revision af de nationale retningslinjer, som selskaberne udgav første gang i 2011 i et samarbejde med Institut for Rationel Farmakoterapi (1, 2).
De fælles anbefalinger vil indgå som en naturlig delmængde af de respektive selskabers behandlingsvejledninger, som vil blive opdateret parallelt.
Behandling af type 2 diabetes er fortsat et område i rivende udvikling. Der er siden sidste revision tilkommet væsentlig evidens fra randomiserede undersøgelser, som på centrale punkter har ændret vores algoritme for den farmakologiske behandling for en række af patienterne med type 2 diabetes, og denne retningslinje har derfor undergået en mere gennemgribende revision sammenlignet med den sidste. Fremadrettet vil regelmæssig revision med mindst 2-3 års mellemrum fortsat være påkrævet.
Det har ligget udenfor arbejdsgruppens kommissorium og resurser at basere revisionen på en selvstændig systematisk litteraturgennemgang inden for vejledningens mange områder. Vejledningen bygger derfor på evidensbaserede konsensusrapporter. Det drejer sig om det europæiske (EASD) og amerikanske (ADA) diabetesselskabs fælles Consensus Report vedrørende behandling af type 2 diabetes (3, 4), den systematiske gennemgang i baggrundsnotatet bag den seneste udgave af Den Nationale Rekommandationsliste, IRF 2020 (5), Medicinrådets systematiske gennemgang af udvalgte problemstillinger (2021) (6), udvalgte nyere GRADE baserede vejledninger og originalartikler samt arbejdsgruppens samlede viden og erfaring.
For at øge læsbarheden er en traditionel gennemgang af centrale studier og direkte kildehenvisninger i rekommandationsafsnit undladt til fordel for en fremhævelse af anbefalingerne.
Indledning
Vi forsøger i denne vejledning at give evidensbaserede retningslinjer for behandling af type 2-diabetes. Risikoen for hjerte-kar-sygdom er central i forhold til den øgede sygdomsbyrde og dødelighed blandt patienter med type 2-diabetes. Muligheden for at reducere denne risiko og forbedre livskvaliteten er helt central for behandlingsstrategien. Sygdommen udviser imidlertid stor diversitet, og en lang række faktorer er af betydning i vurderingen af patienten og i valg af behandlingstilbud. Der er derfor generel enighed om, at behandlingen af type 2-diabetes ikke kun skal være evidensbaseret men også personcentreret og baseret på fælles beslutning om behandlingsmål og behandlingsstrategi. Den potentielle kompleksitet i dette er skitseret i figur 1, som er inspireret af og oversat fra ADA/EASD Consensus Report (3). Ud over de faktuelle risikofaktorer (se nedenfor under ’farmakologisk behandling’), der kan anvendes til at stratificere patienterne, er psykisk og somatisk komorbiditet, motivation, adhærens samt kulturelle og socioøkonomiske forhold væsentlige for et fælles mål og succes af behandlingen.
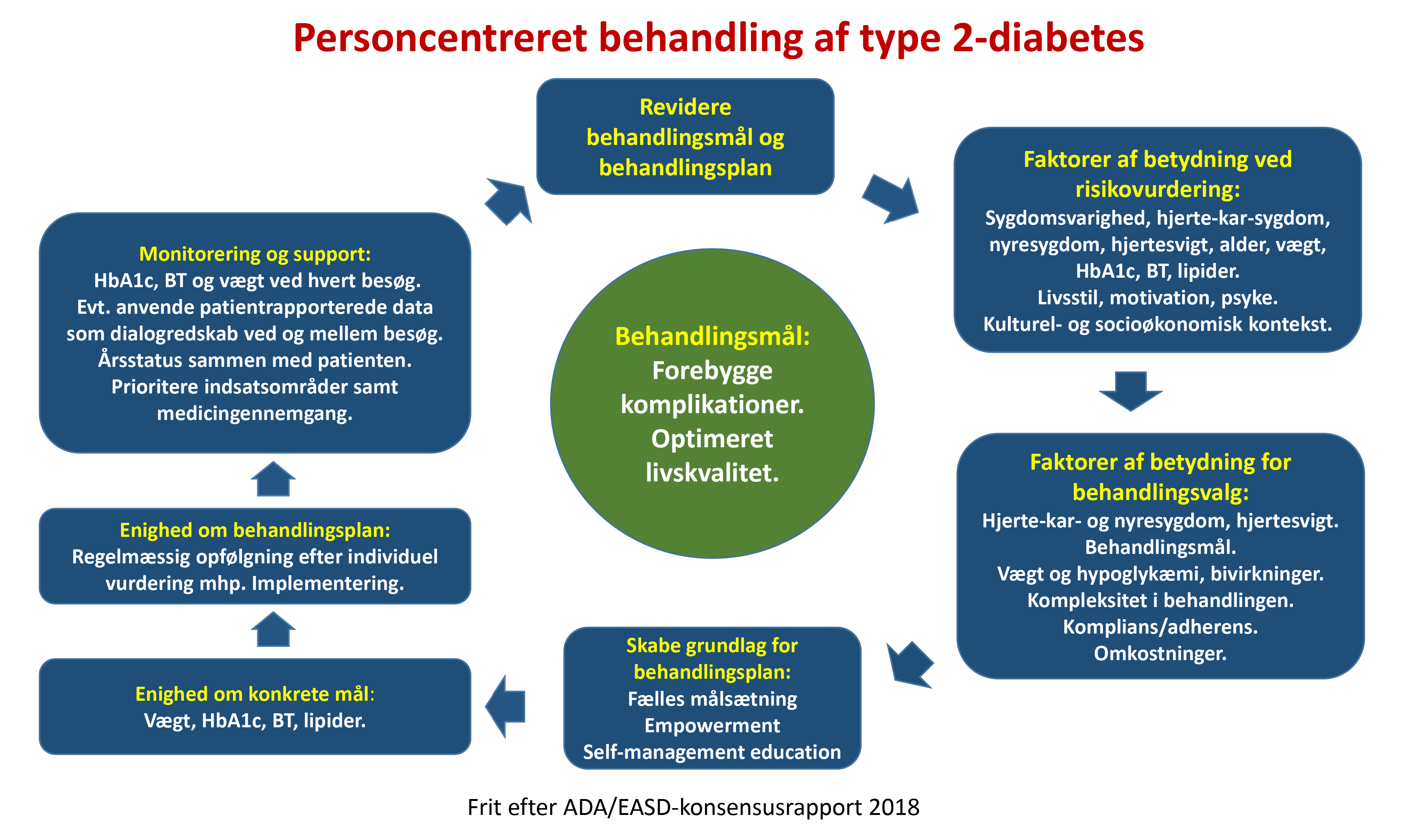
Figur 1. Oversigt over personcentreret behandling af type 2 diabetes. Frit oversat og inspireret af ADA/EASD Consensus Report, 2018.
Livsstilsintervention består af:
- sygdomsspecifik patientuddannelse:
- viden og kunnen
- mestringsevne (’self-management’)
- ernærings- og diætbehandling
- rådgivning/program for fysisk aktivitet
- rygeafvænning.
Det er grundlæggende vigtigt, at patienten tilbydes den nødvendige sygdomsspecifikke patientuddannelse inklusive støtte til kostomlægning, ernærings- og diætbehandling og råd om eller program for øget fysisk aktivitet. Målet er en styrkelse af mestringsevnen og en ændring af en uhensigtsmæssig levevis.
Hos nogle patienter har en omlægning af en uhensigtsmæssig livsstil ofte stor effekt på den glykæmiske kontrol, de kardiovaskulære risikofaktorer og behovet for farmakologisk behandling (9-11). Især ved en intensiv indsats i de første år efter debut, vil man hos mange kunne opnå en markant bedring af den glykæmiske regulation, hvis der opnås et stort vægttab (5-15 %) (9).
Evidensen for effekt på hovedsagelig glukoseniveauet af livsstilsintervention er gennemgået systematisk af Sundhedsstyrelsen i en national klinisk retningslinje (12). Den anbefaler, at patienter med type 2-diabetes tilbydes en sammenhængende, enten individuelt tilrettelagt eller gruppebaseret, livsstilsintervention frem for en ad hoc-indsats. Der bør henvises til ernærings- og diætvejledning ved diætist frem for kostråd samt et træningsforløb frem for motionsråd. Patientuddannelsen bør være baseret på styrkelse af patientens egenomsorg (”self-management”). Herudover er der nogen evidens for at tilbyde specielle, skræddersyede tilbud til særligt sårbare grupper, herunder etniske minoriteter. Desuden bør rygeafvænning tilbydes alle rygere. Henvisning til et kommunalt rygestoptilbud anbefales.
Trods den dokumenterede effekt af livsstilsintervention er det erfaringsmæssigt en vanskelig opgave at opnå resultater for hele populationen af patienter med type 2-diabetes. En anden udfordring er at finde brugbare tilbud, som kan understøtte fastholdelsen af en ændret livsstil.
Livsstilsinterventionen, som beskrevet i regionale forløbsprogrammer, tilbydes i alle kommuner.
Tilbud kan tilgås via SOFT-portalen (https://www.sundhed.dk/borger/guides/sundhedstilbud). Alle patienter med type 2-diabetes bør opfordres til deltagelse i disse gruppebaserede rehabiliteringsforløb. Patienten kan selv henvende sig eller henvises fra almen praksis eller fra hospitalerne. Ved henvisning fra almen praksis eller hospital vil patienten initialt blive kontaktet fra kommunen mhp. en afklarende samtale i kommunen. I den afklarende samtale tilrettelægger kommunen et gruppebaseret eller individuelt forebyggelsestilbud med udgangspunkt i borgerens funktionsevne, sygdomssituation og motivation. Er et kommunalt rehabiliteringsforløb ikke gennemførligt, eller ønsker patienten ikke dette, bør livsstilsinterventionen søges gennemført individuelt. Hospitalerne har rehabiliteringstilbud tilpasset deres målgrupper, disse tilbud er tit individuelle frem for gruppebaserede.
En personcentreret tilgang til behandlingen af type 2-diabetes betyder, at patientens præferencer, motivation, psykosociale forhold m.m. altid spiller en afgørende rolle ved planlægning af behandlingen. Mange ønsker eksempelvis at afprøve effekten af livsstilsændring inden initiering af metformin, og patientens økonomi spiller en væsentlig rolle for 2. og 3. valget efter metformin. Desuden er forekomsten af bivirkninger en af flere væsentlige faktorer af betydning for komplians og adhærens til behandlingen.
Trods disse forhold bør man tilstræbe at informere om og tilbyde den evidensbaserede farmakologiske behandling, som er mest gunstig for prognosen, og som reducerer risikoen for udvikling eller forværring af mikro- og makrovaskulære komplikationer. Dette er opsummeret nedenfor og behandles desuden indgående i de følgende afsnit.
Den risikostratificering, som er grundlaget for valg af behandling og behandlingsmål, omfatter faktorer af betydning for udvikling og progression af mikrovaskulære komplikationer (se nedenfor) og kardiovaskulære risikofaktorer.
De kardiovaskulære risikofaktorer omfatter:
- Over 3 af følgende faktorer:
- Alder > 60 år
- Mandligt køn
- Familiær disposition til tidlig debut af kardiovaskulær sygdom (< 55 år for mænd, < 65 år for kvinder)
- Dysreguleret hypertension > 130/80 mmHg trods behandling
- Dyslipidæmi LDL > 1,8 mmol/l trods behandling
- Rygning > 10 pakkeår
Den samlede behandling af type 2-diabetes omfatter således:
- Livsstilsintervention som basisbehandling uanset den videre farmakologiske behandling
- Farmakologisk behandling:
- Behandling af hyperglykæmi
- Behandling af blodtryk
- Behandling af albuminuri og nedsat nyrefunktion
- Behandling af dyslipidæmi
- Antitrombotisk behandling.
Rationale for forebyggende behandling af:
Glukoseniveauet (målt med HbA1c) er den vigtigste bestemmende faktor for udviklingen og progressionen af mikrovaskulære komplikationer (øjen-, nyre- og nervekomplikationer). Risikoen stiger eksponentielt med stigende HbA1c over tid. Sammenlignet med HbA1c på 48-58 mmol/mol er risikoen for komplikationer øget ca. 3 gange ved HbA1c på 70-80 mmol/mol og ca. 6 gange ved HbA1c på 90-100 mmol/mol.
Rygestop er vigtig i forebyggelsen af progressionen af mikrovaskulære komplikationer.
Hvad angår diabetisk nefropati, er der desuden evidens for, at nogle af de glukosesænkende lægemidler har en nyrebeskyttende effekt, som ligger ud over den glukosesænkende effekt.
Antihypertensiv behandling forebygger progressionen af diabetisk øjensygdom samt udvikling og progression af diabetisk nyresygdom.
Type 2-diabetes er ofte ledsaget af dyslipidæmi og hypertension, som bidrager til en høj kardiovaskulær risiko. Der er evidens for, at lipidsænkende behandling og farmakologisk behandling af blodtryksforhøjelsen reducerer denne risiko, både hvis der er erkendt hjerte-kar-sygdom (sekundær prævention), eller hvis den samlede risiko vurderet ud fra lipideniveau, blodtryk, forekomst af mikroalbuminuri, rygning, køn, arvelig disposition m.m. er høj (primær prævention). Antitrombotisk behandling (f.eks. acetylsalicylsyre) reducerer risikoen for død hos patienter med kendt hjerte-kar-sygdom.
En systematisk og intensiv livsstils- og farmakologisk behandling af alle risikofaktorerne hos patienter med øget proteinudskillelse i urinen (mikroalbuminuri) reducerer mortaliteten og risikoen for både hjerte-kar-sygdom og mikrovaskulære komplikationer.
Sammenlignet med behandling af hypertension og dyslipidæmi er betydningen af behandlingen af glukoseniveauet for udviklingen og progressionen af hjerte-kar-sygdom mere uklar. God blodsukkerkontrol opnået hurtigt efter sygdomsdebut er associeret med en mindsket kardiovaskulær risiko på lang sigt. Omvendt kan en tilsigtet farmakologisk nær-normalisering af glukoseniveauet med mange lægemidler sent i et kompliceret sygdomsforløb være ledsaget af øget risiko. Derfor bør det glykæmiske behandlingsmål individualiseres som skitseret i afsnittet ”Farmakologisk behandling af hyperglykæmi”.
Ydermere har de senere års forskning vist, at behandling med sodium glucose co-transporter (SGLT-2-hæmmere) og de fleste markedsførte glucagon like peptide-1 receptor agonister (GLP-1 RA) er ledsaget af en reduceret kardiovaskulær risiko, der ikke er relateret til den glukosesænkende virkning.
Størrelsen af denne kardiovaskulære risikoreduktion ved intensiv behandling af risikofaktorerne og tilvalg af SGLT-2-hæmmere eller GLP-1 RA i den glukosesænkende behandling afhænger af den ovenfor anførte risikostratificering af patienten. Jo højere risiko, jo større absolut risikoreduktion.
Visitation og tværsektorielt samarbejde
Som udgangspunkt og i henhold til gældende overenskomst udredes og behandles type 2-diabetespatienten i almen praksis. Hvornår behandlingen er så kompleks eller risikoen så stor, at regelmæssig kontrol i hospitalssektoren bør anbefales, er formuleret i regionale visitationskriterier. Hensynet til patientens præferencer, sammenhængen i forløbet og uensartede kompetencer i praksis gør, at disse kriterier er vejledende. Til dette er det afgørende, at der er let adgang til specialistrådgivning og videndeling, samt at der er samarbejdsrelationer med den kommunale rehabilitering og en lokal organisation, der sikrer fælles målsætninger og kompetenceudvikling.
Den non-kompliante patient
På trods af en personcentreret tilgang opnår en ikke ubetydelig andel af patientpopulationen ikke de anbefalede behandlingsmål. En forklarende faktor kan være generelt dårlig komplians og/eller svigtende adhærens til den aftalte behandling. Dette har potentielt store konsekvenser, herunder flere komplikationer, højere dødelighed, større omkostninger for sundhedsvæsenet m.m.
Der er imidlertid mange årsager til dårlig komplians: Glemsomhed, manglende forståelse for konsekvenserne af manglende behandling (både på kort og længere sigt), nervøsitet over for bivirkninger (inklusive hypoglykæmi), betydende komorbiditet, sproglige og kulturelle barrierer, dårlig økonomi, nåleskræk ved injektionsbehandling, at behandlingen forekommer for kompleks (f.eks. mange forskellige præparater) samt gradvis udmattelse over at varetage behandlingen (”diabetes fatigue”).
I behandlingen af den nonkompliante patient er det afgørende at identificere og afdække baggrunden for den manglende komplians. Hvis det drejer sig om simpel glemsomhed, kan dosisæsker, medicin-app eller medicinomlægning (f.eks. til insulin morgen frem for aften eller kombinationspræparater) være en løsning. Hvis økonomien er afgørende, kan det være nødvendigt at omlægge til billigere medicin, f.eks. sulfonylurinstof. Hvis den manglende komplians omvendt bunder i patientens bevidste eller ubevidste modstand mod behandlingen, er det den sundhedsprofessionelles opgave igennem en øget patientinddragelse og fælles beslutningstagning at søge at ændre dette.
Der er evidens for, at patientinddragelse har en stor betydning. Velinformerede patienter udviser større komplians, større tilfredshed med behandlingen og bedre behandlingsresultater. Derudover er god læge-patient-kommunikation positivt associeret til forbedrede behandlingsresultater. Den måde, den lægelige samtale struktureres, og informationen præsenteres, har betydning for, om patienter reelt får medindflydelse på egen behandling.
Fælles beslutningstagning er en behandlingsbeslutningsmodel, der tager udgangspunkt i, at lægen formidler medicinsk viden til patienten, og at patientens perspektiver og præferencer inddrages i den kliniske samtale. Patientpræferencer forstås som de forhold i patientens liv, der afgør, hvad der vil være den bedste behandling for lige netop ham/hende, såvel som vedkommendes egen afvejning af, hvad der vægter mest (f.eks. at kunne beholde jobbet som lastbilchauffør, fremtidig risiko eller bivirkninger her og nu). Fælles beslutningstagning lægger således op til, at patienter tager del i og får øget indflydelse på de behandlingsmæssige beslutninger og således øget komplians til behandlingen.
Endvidere er det velkendt, at behandlingskomplians er lavere i patientpopulationer med psykosociale udfordringer. Derfor er et særligt, ofte tværfagligt forankret, fokus på og støtte til den skrøbelige patient nødvendig for at højne kompliansen, bedre behandlingsresultaterne og på samfundsmæssigt plan skabe mere lighed i sundhed.
For den ældre patient kan kognitiv svækkelse med glemsomhed og forvirring, synsproblemer, dårlig økonomi, praktiske problemer med f.eks. blisterpakninger, der kan være svære at åbne, synkevanskeligheder mv. alle være faktorer, der bidrager til manglende komplians. Det anbefales i særlig grad til denne patientgruppe at anvende enkle regimer (højst medicin 2 x dagligt) og sørge for skriftlig information til den ældre patient, samt evt. pårørende og hjemmesygeplejen.
Farmakologisk behandling af hyperglykæmi
Rationale for behandling
Som nævnt i indledningen er glukoseniveauet den vigtigste bestemmende faktor for udviklingen og progressionen af mikrovaskulære komplikationer (øjen-, nyre- og nervekomplikationer (1).
Tidlig etablering af god glykæmisk kontrol er sammen med antihypertensiva og statinbehandling medvirkende til at reducere den langsigtede risiko for makrovaskulære komplikationer. Ydermere har senere års introduktion af særligt sodium glucose co-transporter (SGLT-2–hæmmere) og glucagon like peptide-1 receptor agonister (GLP-1 RA)vist organbeskyttende effekter i forhold til både nyre- og hjerte-kar-sygdom, som rækker ud over de glykæmiske effekter og derfor anbefales uafhængigt af HbA1c til særlige grupper.
Behandlingsmål
Behandlingsmålet for type 2-diabetes individualiseres, hvor der tilstræbes lavest mulig HbA1c uden hypoglykæmi og uhensigtsmæssig polyfarmaci. Især skal lægemidler med risiko for hypoglykæmi (sulfonylurinstof, insulin) bruges med forsigtighed.
Behandlingsmål for HbA1c
| HbA1c ≤ 48 mmol/mol Bør tilstræbes, hvor det er gennemførligt uden større risiko for hypoglykæmi. Dette anses for at være vigtigt for forebyggelsen af komplikationer på lang sigt. HbA1c ≤ 53 mmol/mol Senere i forløbet kan en stram kontrol blive tiltagende vanskelig, og der må sættes individuelle mål for behandlingen, hvor risikoen for hypoglykæmi og det realistisk opnåelige opvejes over for risikoen for diabetiske komplikationer. HbA1c ≤ 58 mmol/mol Hos skrøbelige patienter (lang diabetesvarighed, fremskreden alder, megen ko-morbiditet) og ved svingende blodglukose, hvor polyfarmaci inkluderer lægemidler med risiko for hypoglykæmi. HbA1c 58-70 mmol/mol Hos patienter, hvor det primære behandlingsmål er symptomfrihed, kan et HbA1c på 58-70 mmol/mol være acceptabelt.
|
Valg af behandling
Ud over den glukosesænkende effekt er en række faktorer af betydning for valget af lægemiddel ved type 2-diabetes. Det drejer sig om faktorer hos den enkelte patient (betacellefunktion, biologisk alder, komorbiditet, overvægt, erhverv, sociale og økonomiske forhold). Herudover har det forventede fald i HbA1c samt gavnlige effekter og eventuelle bivirkninger ved lægemidlet betydning. Nedenfor er anført den generelle algoritme for den farmakologiske behandling af hyperglykæmi, der gør sig gældende for de fleste patienter. Efterfølgende beskrives anbefalinger, der gør sig gældende for en række subgrupper af patienter (patienter med hjertesygdom, nyresygdom, overvægt, fremskreden alder, psykisk sygdom og steroidbehandlede patienter).
Den generelle algoritme
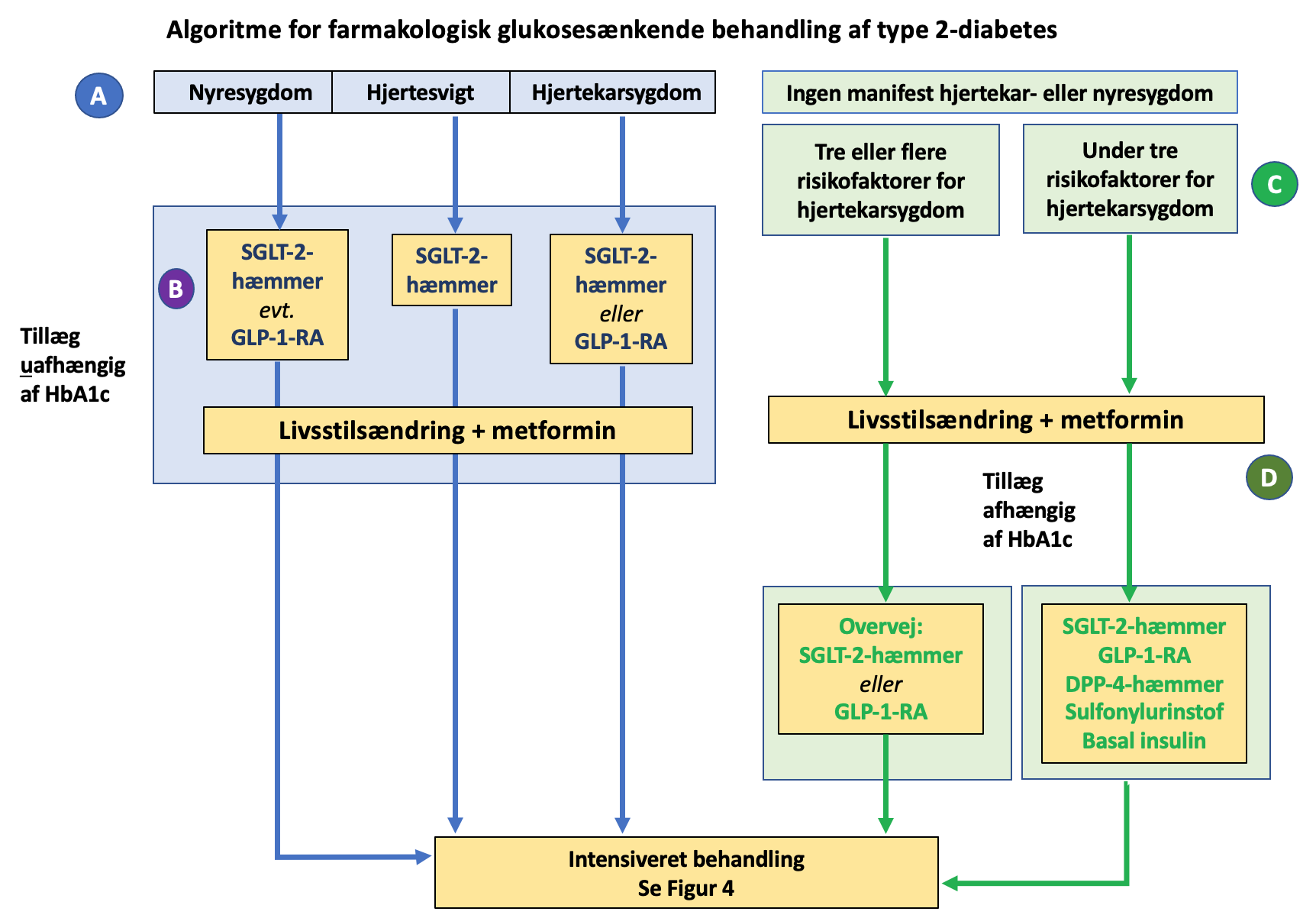
Figur 2: Den generelle behandlingsalgoritme.
- (A) Hjertekarsygdom = iskæmisk hjertesygdom, cerebral iskæmi, perifer arteriel insufficiens. Hjertesvigt = både med nedsat og bevaret LVEF. Nyresygdom = nedsat nyrefunktion (eGFR<60 ml/min/1.73 m2) og/eller albuminuri (≥ 30 mg/g)
- (B) 2. valget uafhængig af opnået HbA1c. Nyre-/hjertebeskyttelse prioriteres før metformin.
- (C) Kardiovaskulære risikofaktorer: Alder > 60 år; Mandligt køn; Familiær disposition til tidlig debut af kardiovaskulær sygdom (<55 år for mænd, < 65 år for kvinder); Dysreguleret hypertension > 130/80 mmHg trods behandling; Dyslipidæmi > 1,8 mmol/l trods behandling; Rygning > 10 pakkeår
- (D) Tillægges hvis behandlingsmålet ikke kan opnås (afhængig af HbA1c). Individuel vurdering baseret på ønsket glukosesænkende effekt, potentiel vægt-reducerende effekt (GLP-1-RA og SGLT-2-hæmmer), egen insulinproduktion (mål evt. C-peptid), potentielle bivirkninger, pris og patientens præferencer i øvrigt. Hverken DPP-4-hæmmer, sulfonylurinstoffer eller insulin medfører en øget kardiovaskulær risiko. Anvendelse af pioglitazon er en specialistopgave og er derfor ikke medtaget i figuren.
Egenskaber ved 2. valgs præparater
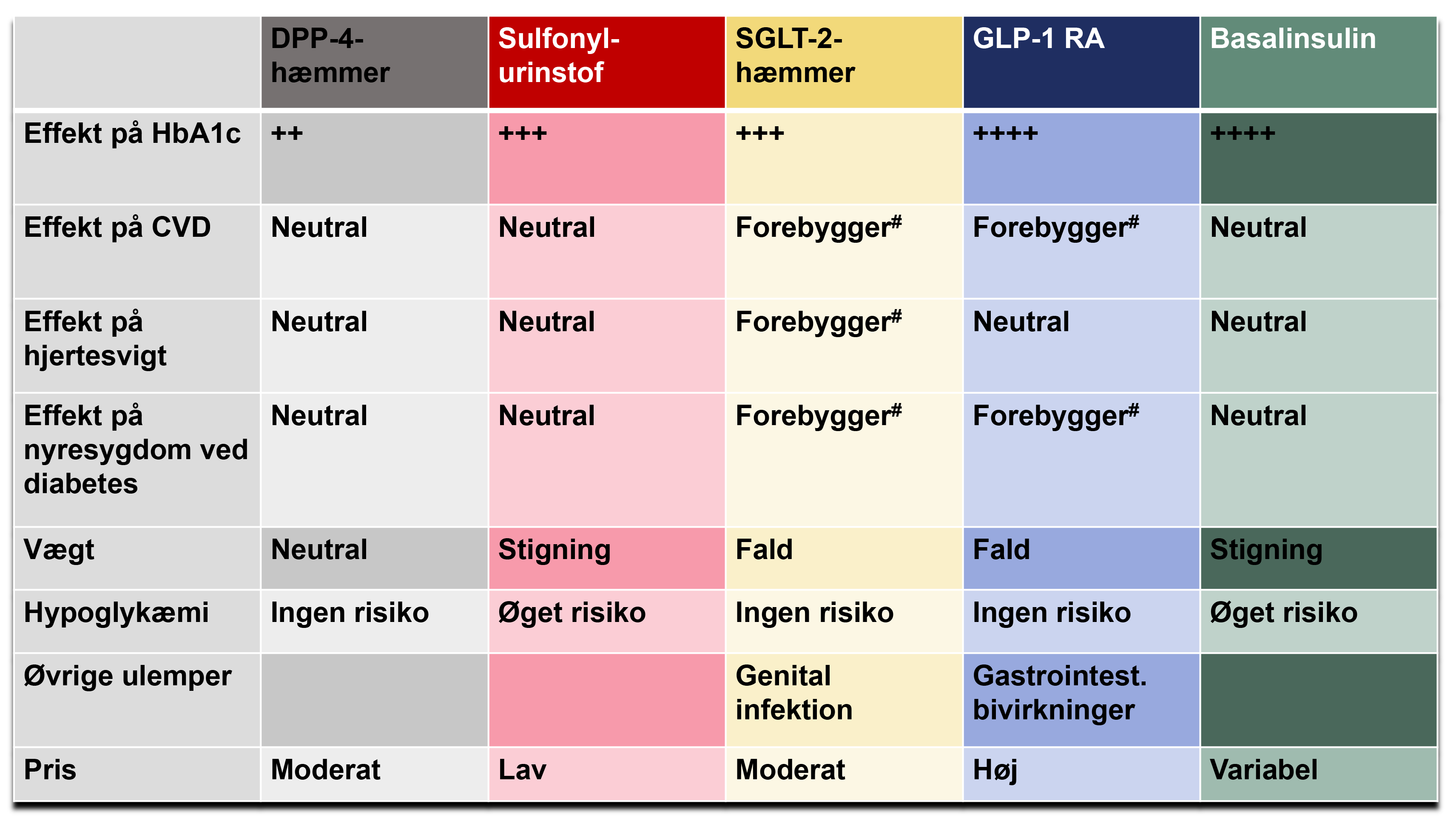
Figur 3:Egenskaber ved de forskellige antiglykæmiske præparater. CVD: hjerte-kar-sygdom. # Ved kendt CVD, nyresygdom, hjertesvigt.
Metformin anbefales som førstevalg, uafhængig af HbA1c, sammen med en individuel tilrettelagt plan for livsstilsændring. Metformin er effektivt, sikkert, billigt og reducerer formentligt på sigt risikoen for hjertesygdom. Behandlingen er ledsaget af et mindre vægttab og giver ikke hypoglykæmi.
Ved hjerte-kar-sygdom, hjertesvigt eller nyresygdom er det dog vigtigt, at implementering af SGLT-2-hæmmer/GLP-1 RA ikke forsinkes af optitrering af metformin. Her kan metformin tillægges efter initiering af SGLT-2-hæmmer/GLP-1 RA. Se nedenfor.
Vær opmærksom på:
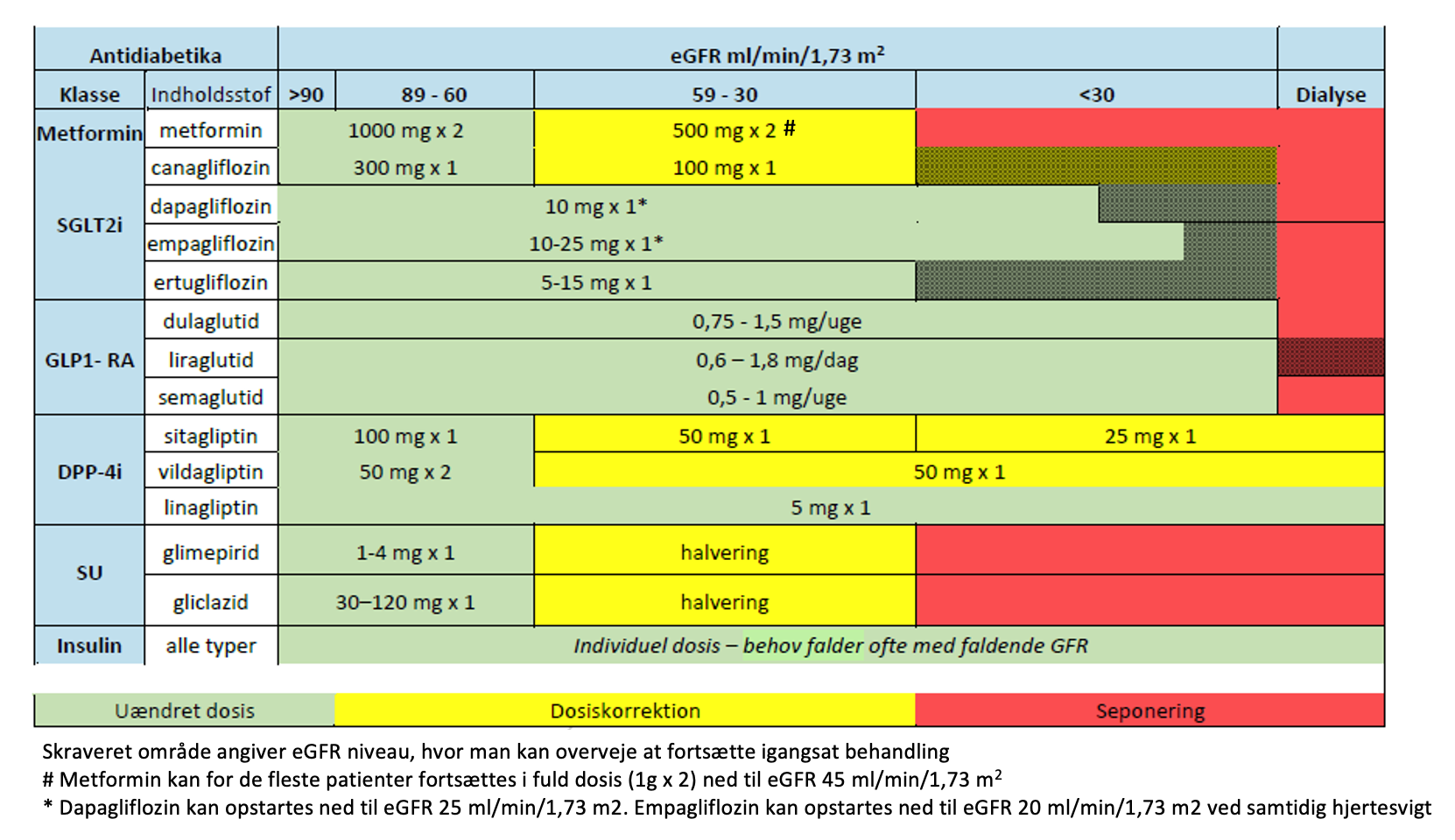
- Metformin er kontraindiceret ved svært nedsat nyrefunktion (eGFR <30 ml/min/1.73 m2), men kan anvendes i halveret dosis hvis eGFR er under 45 ml/min/1.73 m2, og dosisreduktion kan ligeledes overvejes ved eGFR 45-59 ved risikofaktorer for hypoperfusion/hypoxæmi.
- Metformin anbefales gradvist optitreret for at mindske bivirkninger (primært gastrointestinale).
- Metforminbehandling skal pauseres ved svær akut sygdom (f.eks. høj feber, vedvarende opkastninger eller diarré), eller hvor der er risiko for svær nedsat nyre- eller leverfunktion (risiko for laktatacidose).
- Op til 10-15 % af patienterne får gastro-intestinale bivirkninger, som dog ofte kan undgås ved langsom dosisoptitrering (ugentligt).
- Øget risiko for B12-mangel, hvorfor B12-vitamin måles hvert 2. år. Ved mangel substitueres med tablet cyanocobalamin (vitamin B12), 1 mg dagligt.
Ved svær dysregulation på diagnosetidspunktet (f.eks. HbA1c > 86 mmol/mol, svære symptomer på hyperglykæmi eller hyperglykæmisk induceret vægttab) overvejes måling af C-peptid. Herudover overvejes tillæg af basalinsulin til korrektion af hyperglykæmi. Denne behandling kan ofte skiftes til anden behandling, når hyperglykæmien er korrigeret (ophør af glukotoksicitet).
Patienter med hjertekarsygdom, hjertesvigt eller nefropati
Ved hjerte-kar-sygdom anbefales enten SGLT-2-hæmmer eller GLP-1 RA, da lægemidler fra begge stofgrupper er påvist at reducere dødelighed og risiko for progression af hjerte-kar-sygdom. Behandlingen anbefales uafhængigt af HbA1c.
Ved hjertesvigt anbefales en SGLT-2-hæmmer, da det er ledsaget af en betydelig reduktion i dødelighed og reduktion af risikoen for indlæggelse for hjertesvigt. Behandlingen anbefales uafhængigt af HbA1c.
Ved nyresygdom anbefales en SGLT-2-hæmmer, da det reducerer progressionen af nyresygdommen. Behandlingen anbefales uafhængigt af HbA1c. Præparatet kan initieres ned til eGFR på 20 ml/min/1.73 m2, men væsketal bør kontrolleres, da der ofte ses et midlertidigt ca. 8% fald i eGFR (≈ 3-5 ml/min/1.73 m2) ved initiering af SGLT-2-hæmmer. Dette skal ikke give anledning til ændringer i behandlingen. Ved eGFR under 45 ml/min/1,73 m2 skal bemærkes, at den glukosesænkende effekt er begrænset. Præparatet kan fortsætte til dialysegrænsen. Hvis SGLT-2-hæmmer ikke tåles anbefales GLP-1 RA, da det reducerer risikoen for forværring af albuminuri og kardiovaskulær sygdom i denne gruppe, og det kan anvendes ned til dialysegrænse.
Patienter uden hjertekarsygdom, hjertesvigt eller nefropati
Hvis patienten ikke har hjerte-kar-sygdom, hjertesvigt eller nyresygdom, hviler beslutningen om valg af lægemidler i tillæg til metformin på en vurdering af patientens risikofaktorer for hjerte-kar-sygdom. Se indledende afsnit samt figurtekst til ”Figur 2. Den generelle behandlingsalgoritme”. Har patienten tre eller flere risikofaktorer, overvejes tillæg af SGLT-2-hæmmer eller GLP-1 RA. Evidensen er ikke så stærk som ved manifest nyre- eller hjertesygdom, blandt andet pga. forskelle i valgte risikofaktorer i de tilgrundliggende studier (jf. Medicinrådets rapport). Har patienten < 3 risikofaktorer, vil tillæg af antiglykæmisk behandling ske ved en afvejning af de beskrevne faktorer hos den enkelte patient og lægemidlernes egenskaber, erfaringsgrundlaget og prisen (Figur 2). Effekten på glukoseniveauet, eventuel vægtændring (uddybes i appendix: Patienten med diabetes og svær overvægt) samt risikoen for hypoglykæmi eller andre bivirkninger er afgørende for den individualiserede behandling. Se figur 2. I begge tilfælde vil tillæg af 2. antiglykæmiske præparat ske, såfremt der er behov for at forbedre den glykæmiske kontrol, altså afhængig af HbA1c.
De enkelte stofgrupper
SGLT-2-hæmmere reducerer den kardiovaskulære risiko, risikoen for indlæggelse for hjertesvigt samt progressionen af diabetisk nyresygdom hos patienter med klinisk iskæmisk hjertesygdom, hjertesvigt og nefropati. Behandlingen bidrager til vægttab.
Anvend primært canagliflozin, dapagliflozin og empagliflozin.
Vær opmærksom på:
- 3-4 gange øget risiko for genital svampeinfektion og muligvis en let øget risiko for urinvejsinfektion. Recidiverende tilfælde bør føre til overvejelser om behandlingsophør.
- Bør pauseres ved svær akut sygdom (f.eks. høj feber, vedvarende opkastninger eller diarré) grundet lille risiko for diabetisk ketoacidose (evt. euglykæmisk ketoacidose).
- Ketoacidose uden anden årsag end SGLT-2-hæmmer-behandling bør føre til overvejelser om behandlingsophør.
- Den glukosesænkende effekt aftager med faldende nyrefunktion, men der er en kardio- og nyreprotektiv effekt helt ned til eGFR 20 ml/min/1.73 m2 hos patienter med diabetisk nefropati.
GLP-1 RA: Ved høj risiko for og ved kendt hjerte-kar-sygdom reducerer GLP-1 RA risikoen for progression af kardiovaskulær sygdom samt for udvikling af diabetisk nyresygdom. GLP-1 RA kan anvendes i stedet for SGLT-2-hæmmer-behandling, hvis denne behandling ikke tåles. Der ses muligvis lidt større vægttab (dog kun omkring 1 kg) sammenlignet med SGLT-2-hæmmere. Der er stor variation i vægtresponset. Tillige ses god effekt hos patienter med nonalkoholisk steatohepatitis.
Anvend primært: dulaglutid, exenatid ugentligt, liraglutid, semaglutid ugentligt (alle subkutan adm.), semaglutid (oral adm. Skal indtages fastende).
Vær opmærksom på:
- Giver hyppigt kvalme og eventuelt opkastninger, hvilket ofte aftager ved længere tids behandling.
- GLP-1 RA anbefales gradvist optitreret for at mindske bivirkninger.
Sulfonylurinstof (SU) reducerer ikke den kardiovaskulære risiko, men kan anvendes som 2.-valg til patienter uden hjerte-kar- eller nyresygdom, eller hvis SGLT-2-hæmmere og GLP-1 RA ikke tåles. Er billigt og effektivt i forhold til at sænke blodsukkerniveauet.
Anvend primært: gliclazid, glimepirid.
Vær opmærksom på:
- Medfører en lille risiko for hypoglykæmi, der dog sjældent er et betydende klinisk problem.
- Giver mindre vægtøgning.
- Øget risiko for hypoglykæmi ved nedsat eGFR (< 60 ml/min/1.73 m2).
Dipeptidyl peptidase-4 (DPP-4) -hæmmer reducerer ikke den kardiovaskulære risiko, men kan anvendes som 2.-valg til patienter uden hjerte-kar- eller nyresygdom, eller hvis SGLT-2-hæmmere og GLP-1 RA ikke tåles. DPP-4-hæmmere kan anvendes i reduceret dosis ved eGFR < 60 ml/min/1.73 m2 og fortsættes under evt. dialyse. Har ofte få bivirkninger og kan derfor være velegnet til skrøbelige ældre patienter.
Anvend primært: alogliptin, linagliptin, sitagliptin.
Vær opmærksom på:
- Mindre glykæmisk effekt end andre antidiabetika.
- Ved hjertesvigt foretrækkes linagliptin og sitagliptin.
- Vægtneutral.
- Dosisreduktion ved nedsat nyrefunktion (fraset linagliptin).
Basalinsulin anvendes primært som 2.-valg ved svær dysregulation (HbA1c > 86 mmol/mol og betydende hyperglykæmiske symptomer) eller ved insulinopen fænotype (slank patient, lav egenproduktion af insulin (f.eks. fastende C-peptid under 300 pmol/l eller hyperglykæmi/måltidsstimuleret C-peptid under 600 pmol/l). Kan desuden bruges som intensivering af behandlingen, hvis andre antidiabetika ikke tåles grundet mange bivirkninger eller f.eks. lav nyrefunktion. Insulin øger ikke den kardiovaskulære risiko.
Anvend primært: insulin glargin 100 IE/ml.
Vær opmærksom på:
- Risiko for hypoglykæmi.
- Vægtstigning.
Der henvises til afsnittet om insulinbehandling.
Glitazoner kan anvendes i udvalgte tilfælde med svær insulinresistens efter forudgående konference med endokrinolog/diabetescenter. Mulig gunstig effekt på kardiovaskulær risiko hos type 2-diabetespatienter med makrovaskulær sygdom samt gunstig effekt hos patienter med nonalkoholisk steatohepatitis.
Anvend: Pioglitazon.
Vær opmærksom på:
- Væskeretention med øget risiko for forværring af hjertesvigt, især ved samtidig insulinbehandling – en kombination, der derfor bør undgås.
- Fordoblet risiko for frakturer hos kvinder.
- Vægtstigning.
Intensiveret behandling
Ved behov for yderligere intensivering efter 2.-valg tillægges øvrige antidiabetika i henhold til en individuel vurdering med samme overvejelser som nævnt under 2.-valg. Se figur 3.
Dog bør følgende kombinationer undgås:
- Sulfonylurinstof (SU) og insulin grundet høj risiko for hypoglykæmi (seponer SU ved start af insulin).
Måltids-/blandingsinsulin: Efter opstart af basalinsulin kan behandlingen intensiveres ved at tillægge måltidsinsulin eller blandingsinsulin til et eller flere måltider i henhold til eventuelle postprandiale stigninger i plasmaglukose. Måltids-/blandingsinsulin-regime anvendes sent i sygdomsforløbet, når der er svigtende egen insulinproduktion eller f.eks. tiltagende dårlig nyrefunktion, som gør det svært at optimere den antiglykæmiske behandling på anden vis.
Anvend primært:
Måltidsinsulin: insulin aspart, insulin (humant).
Blandingsinsulin: insulin aspart/insulin aspart protamin.
Der henvises til afsnit om insulinbehandling.
Kombinationer ved intensiveret behandling

Figur 4: Kombinationsbehandling.
Monitorering af behandlingen
Diabetespatienter, der ikke er i insulinbehandling, behøver ikke rutinemæssigt måle blodsukkerværdier hjemme. Patienten bør dog måle blodsukre, hvis der er mistanke om hypoglykæmitilfælde hos patienter i behandling med sulfonylurinstof-stoffer, eller hvis patienten skal initiere anden behandling – som f.eks. prednisolon eller lignende – som mere akut øger blodsukkeret. Desuden kan monitorering være afklarende ved tvivl om præparatvalg og have et pædagogisk sigte i forbindelse med intensivering af behandlingen.
Alle patienter i insulinbehandling eller sulfonylurinstof skal oplæres i hjemmemåling af blodsukker og instrueres i korrekt anvendelse af dette.
- Ved påbegyndelse af insulin eller sulfonylurinstof
- Ved behov for titrering af insulindosis med henblik på optimering af blodsukkerregulationen
- Ved svingende blodsukkerniveau
- Ved tilstande med øget risiko for hypoglykæmi (som nævnt ovenfor), herunder sygdom (f.eks. opkastning, diarré, og excessiv alkoholindtagelse)
- Ved interkurrent sygdom, hvor f.eks. febrilia giver hyperglykæmi
- Ved dårlig injektionsteknik, som øger dag-til-dag-variationen i insulinoptagelsen
- Ved lav HbA1c (< 48 mmol/mol).
Ved stabil og tilfredsstillende HbA1c måles blodglukoseværdier 2 gange ugentligt hver 2. uge og i 3 dage før næste kontrol. Ved bilkørsel skal der måles før dette.
Insulinbehandling
Rationale for behandling
Insulinbehandling af patienter med type 2-diabetes kan være indiceret fra debut, hvis metformin eller øvrige antidiabetika er kontraindicerede eller samtidig med metformin ved svær dysregulation med HbA1c >86 mmol/mol og betydende hyperglykæmiske symptomer (1). Ved mistanke om type 1-diabetes eller sekundær diabetes til f.eks. kronisk pankreatit, skal diabetisk ketoacidose udelukkes. Hvis insulinbehandlingen påbegyndes ved debut, kan behandlingen evt. senere erstattes af eller suppleres med anden glukosesænkende behandling, når situationen er afklaret.
Herudover kan der være indikation for insulinopstart på et hvilket som helst tidspunkt i sygdomsforløbet, hvis hyperglykæmien ikke kan kontrolleres på anden vis. Man bør dog være ekstra påpasselig med at overveje indikation ved erhverv som f.eks. buschauffør eller stilladsarbejder, ved aktivt alkoholmisbrug, ved svær fedme og hos (ældre) kognitivt påvirkede, der ikke selvstændigt kan reagere på symptomer på hypoglykæmi, da risikoen ved behandlingen kan overstige fordelene. Insulinbehandling kan være et alternativ til ældre eller plejehjemspatienter, selv terminale, ved HbA1c> 75 mmol/mol, især hvis kontrol med symptomatisk hyperglykæmi er vanskelig.
Før opstart skal patienten oplæres i blodsukkermonitorering, hvis det ikke allerede er gjort, og det skal sikres, at kommunen ansøges om tilskud til det nødvendige antal teststrimler, fingerprikker/lancetter og halvdelen af den samlede udgift til apparater til måling af blodsukker.
Ved start på insulinbehandling af type 2-diabetes anbefales basalinsulinregime bestående af:
| Langtidsvirkende analog insulin administreret 1 gang dagligt (mane) |
Det er et simpelt og sikkert regime. Flertallet af patienter vil herved kunne opnå og fastholde behandlingsmålet med lille risiko for hypoglykæmi. Alvorlig hypoglykæmi (insulintilfælde) i forbindelse med basalinsulinbehandling af type 2-diabetes er sjælden, dvs. højst 2-3 % vil opleve det i løbet af et år (2).
Almindelige bivirkninger inkluderer hypoglykæmi og vægtøgning.
Risikofaktorer for hypoglykæmi:
- For høj dosis
- Forkert injektionsteknik (f.eks. injektion af insulin intramuskulært snarere end subkutant kan øge absorptionshastigheden med 50 %)
- Injektionsinfiltrater
- Manglende måltider eller måltider uden tilstrækkelig med kulhydrat
- Alkoholindtag
- Motion eller ikke-planlagt fysisk aktivitet
- Behandling med sulfonylurinstoffer
- Nedsat insulinclearance (f.eks. nyresvigt)
- Ændringer i andre medikamenter (f.eks. reduktion eller ophør af binyrebarkhormon).
Strategier til forebyggelse af hypoglykæmi inkluderer undervisning om hypoglykæmiske symptomer, struktureret hjemmemåling af blodglukose og viden om forebyggende tiltag i risikosituationer. Vær særlig opmærksom på patienter, der tidligere har haft hypoglykæmi, da der i denne gruppe vil være en øget risiko for gentagelser (3,4). Der kan være behov for deling af insulindosis eller for at flytte doseringstidspunktet. Ved recidiverende uforklaret hypoglykæmi bør det overvejes, om patienten har udviklet konkurrerende sygdom som f.eks. cancer.
Kombinationsmuligheder med andre antidiabetika
Insulin kan med fordel kombineres med en række andre typer antidiabetika:
- Både normalvægtige og overvægtige bør fortsætte behandlingen med metformin ved start af insulin, da det nedsætter det absolutte insulinbehov og risikoen for vægtøgning. Kombinationsbehandlingen bevirker, at insulinbehovet er op til 25 % mindre end ved insulin i monoterapi. Dette medfører en lidt lavere risiko for hypoglykæmi.
- Insulin og GLP-1 RA kan kombineres. Hvis insulinbehandlingen suppleres med GLP-1 RA og HbA1c er under ca. 60 mmol/mol, bør basalinsulindosis som hovedregel reduceres med 20 %. Hvis der udover basalinsulin administreres måltidsinsulin, pauseres eller reduceres dette med mindst 50 % de næste dage indtil effekten på blodsukrene er vurderet, og man skal være opmærksom på hypoglykæmi.
- Insulin og SGLT-2-hæmmere kan kombineres. Hvis insulinbehandlingen suppleres med SGLT-2-hæmmere, og HbA1c er under 60 mmol/mol, bør insulindosis som hovedregel reduceres 20 %. Mindre reduktion i insulin kan overvejes ved nedsat nyrefunktion. Hvis patienten er langt fra HbA1c-mål, kan øgning i insulindosis være nødvendig i den første tid efter tillæg af SGLT-2-hæmmer, afhængig af blodsukkerprofil.
- Ved opstart af insulin kan DPP-4-hæmmere eventuelt fortsættes.
- Kombinationsbehandling med sulfonylurinstof frarådes på grund af risiko for hypoglykæmi.
Anvend primært: insulin glargin 100 IE/ml.
Alle basalinsuliner giver en klinisk relevant sænkning af HbA1c, men risikoen for hypoglykæmi er generelt lavere ved behandling med glargin 100E, glargin 300E, degludec og detemir i forhold til behandling med humant isophaninsulin (NPH) (IRF National rekommandationsliste). Både glargin 300E og degludec er vist at være associeret med en lavere risiko for især natlig hypoglykæmi sammenlignet med glargin 100E (5-7). Hvorvidt dette indebærer fordele for størsteparten af patienter med type 2-diabetes, eller om det hovedsagelig omfatter patienter i øget risiko for hypoglykæmi, f.eks. ved tidligere symptomatisk hypoglykæmi, nedsat nyrefunktion, hjertesygdom eller langvarig diabetes er ikke afklaret. Head-to-head studier mellem glargin 300 og degludec har ikke vist sikker forskel med hensyn til risikoen for hypoglykæmi (8,9). For detemir er der ikke gennemført kardiovaskulære outcome studier, og derfor bør detemir kun anvendes i tilfælde, hvor øvrige basalinsuliner ikke er egnede.
Hvordan titreres basalinsulin?
Langtidsvirkende analog insulin gives typisk om morgenen. Plasmaglukose målt før morgenmaden og evt. før aftensmaden anvendes til titrering af dosis ud fra princippet”Fix Fasting First”.
- Begynd f.eks. med at give 10 IE insulin morgen (ved sværere dysregulation og/eller insulinresistens kan højere startdosis overvejes, f.eks. 0,2 IE/kg).
Patienten ses (eller der tages telefonisk kontakt) dagen efter første injektion og derefter hver 3.-4. dag til justering af dosis (Figur 5). Glargin 300 IE/ml og degludec justeres hver 5.-7. dag. Det kan være nødvendigt at justere doseringsskemaet i situationer med svær insulinresistens, hvor plasmaglukose ikke ændrer sig nævneværdigt. Det er som hovedregel ikke nødvendigt at dele dosis i morgen og aften, men ved enkeltdoser på over 40–50 IE overvejes en fordeling på flere injektionssteder.
- Ved meget høje insulindoser (typisk svært insulinresistente patienter) har insulin glargin 300 IE/ml og insulin degludec 200 IE/ml en fordel ved den højere insulinkoncentration per ml. Her kan for insulin glargin gives hhv. 80 enheder (solostar pen) og 160 enheder (double star pen) og for insulin degludec 160 enheder, før enkeltdoser skal fordeles på flere injektionssteder.
| Præprandial glukoseværdi | Ændring i insulin dosis |
| >12 mmol/l | + 8 IE |
| 10-12 mmol/l | + 4-6 IE |
| 8-10 mmol/l | + 2-4 IE |
| 4-8 mmol/l | Uændret |
| <4 mmol/l | – 2 IE |
Figur 5: Præprandielle glukoseværdier målt dagligt af patienten i 3-7 dage før dosisjustering. Skemaet er vejledende, dvs. ændringerne i insulindosis i titreringsfasen samt mål-glukose bør altid vurderes individuelt.
Basalinsuliner er alle udviklet til at have en jævn plasmaprofil over døgnet, men har forskellig farmakokinetik (dvs. lægemidlets absorption, metabolisme, fordeling og udskillelse fra organismen), og prisen varierer også betydeligt. Nyere insulinanaloger har længere tid til maksimal plasmakoncentration og halveringstid, hvilket resulterer i en længere virkningsvarighed og stabil plasmakoncentration.
Der kan være flere forskellige grunde til ønske om skift, f.eks.:
- at skifte til et billigere/tilskudsberettiget præparat
- at skifte til et præparat med mindre risiko for natlig hypoglykæmi
- at skifte til et præparat med længere halveringstid
- at skifte til et mere koncentreret præparat
- at skifte til regime med mere fleksibelt doseringstidspunkt.
Efter skiftet er det vigtigt med tæt opfølgning og blodsukkermonitorering i overgangsperioden og de første behandlingsuger derefter.
Figur 6: Forslag til dosisjustering ved skift af basalinsuliner baseret på farmakokinetik og -dynamik af basalinsuliner. Fra Rationel Farmakoterapi: https://www.ss.dk/da/Udgivelser/2020/Rationel-Farmakoterapi-3-2020.
Efter valg af behandlingsregime bør dette principielt udnyttes til bunds. Det vil sige, at behandlingen intensiveres med det valgte regime, så længe det individuelle behandlingsmål ikke er opfyldt (eller kan vedligeholdes) i løbet af 3-6 måneder – indtil man støder på vanskeligheder, der gør det rimeligt at skifte til andet behandlingsregime. Det kunne være hypoglykæmi og/eller vedvarende for høje postprandiale glukosestigninger, der forhindrer, at HbA1c når i mål.
Herefter suppleres fasteblodglukosemåling med glukosemålinger (1½ – 2 timer efter måltiderne) til vurdering af den postprandiale blodglukosestigning. Dette vil afklare, om der bør suppleres med hurtigtvirkende måltidsinsulin.
Korttidsvirkende insulin kan indgå i forskellige insulinregimer i kombination med basalinsulin, dvs. langtidsvirkende analog insulin, der gives 1 gang i døgnet, eller intermediært virkende NPH-insulin, der gives 1-2 gange i døgnet.
Insulinregimer:
- Basal/bolus insulinbehandling, dvs. langtidsvirkende insulin 1-2 gange i døgnet + hurtigvirkende insulin til et eller flere måltider – i alt 3-5 injektioner per døgn.
- Blandingsinsulin, der gives til et eller flere måltider, dvs. 1-3 gange i døgnet.
Valg af regime afhænger af det fastlagte behandlingsmål, forventet komplians (ikke alene med behandling, men også med monitorering inkl. hjemmemåling af blodglukose) og eventuelt et estimat for betacellefunktionen. Bevaret betacellefunktion (stimuleret C-peptid > 600 pmol/L) taler for, at patienten ikke har behov for hurtigtvirkende insulin, og at en kombination med GLP-1 RA kan være løsningen.
Overgang fra basalinsulin til blandingsinsulin
- I titreringsfasen anbefales måling af glukoseværdier før og 1½-2 timer efter morgen- og aftensmåltidet indtil tilsigtet kontrol.
- Begynd med samme døgndosis fordelt på 1-2 doser, til morgen- eller aftensmåltidet eller fordelt på begge vejledt af målte glukoseværdier.
- Juster dosis efter både præ- og postprandiale glukoseværdier indtil tilsigtet kontrol.
Overgang fra basalinsulin eller blandingsinsulin til basal/bolus
– I titreringsfasen anbefales måling af glukoseværdier før de tre hovedmåltider eller før morgenmad og 1½-2 timer efter morgen- og aftensmåltidet.
– Døgndosis basalinsulin fastholdes eller reduceres med ca. 10 %, hvis HbA1c er under 60 mmol/mol. Begynd hurtigvirkende insulin ved at give 10 % af døgndosis til det måltid med den største postprandiale stigning, og øg dosis med 10-15 % hver 3.-5. dag til målet for postprandial glukosekontrol er nået. Tillæg insulin efter samme princip til de øvrige hovedmåltider ved behov.
– Juster måltidsdosis på baggrund af glukoseværdier målt før efterfølgende måltid eller 1½-2 timer efter morgen og aftensmad.
Farmakologisk behandling af blodtryk
Rationale for behandling
Studier inkluderende diabetespatienter har vist effekt på mikro- og makrovaskulære komplikationer ved reduktion i systolisk blodtryk (BT) til < 130-135 mmHg (1, 2, 3), mens der er vist en reduktion i risikoen for apopleksi og proteinuri ved reduktion i systolisk BT til < 120 mmHg, dog på bekostning af en let øget forekomst af bivirkninger, primært svimmelhed og stigning i p-kreatinin (4).
En nylig, stor metaanalyse (5) har vist en 10 % risikoreduktion for kardiovaskulære hændelser pr. 5 mmHg reduktion i systolisk blodtryk helt ned i det normale område (< 120 mmHg), uafhængigt af udgangsværdien for systolisk blodtryk.
Behandlingsmål
Ud fra en samlet vurdering af evidensen anbefaler arbejdsgruppen, i overensstemmelse med de seneste fælles guidelines fra det europæiske kardiologiske og hypertensionsselskab (ESC/ESH) og fra Dansk Cardiologisk Selskab (https://nbv.cardio.dk/diabetes), et generelt blodtryksmål på < 130/80 mmHg ved type 2-diabetes, idet man i nogle tilfælde bør sætte højere individuelle mål (BT < 140/85 mmHg), f.eks. ved langvarig diabetes, høj biologisk alder og behandlingsresistens for at undgå bivirkninger.
Diagnostik og behandling af hypertension bør understøttes af hjemme-BT-måling og/eller døgn-BT-måling (6). Reproducerbarheden af enkeltmålinger af blodtryk er ringe, og det er derfor vigtigt at supplere med døgn‐ eller hjemmeblodtryksmåling for at sikre en pålidelig fastlæggelse af niveauet og for at undgå overbehandling af patienter med white coat-hypertension.
Behandlingsmål for blodtryk
| Blodtryk < 130/80 mmHg Det generelle behandlingsmål for blodtrykket ved type 2-diabetes målt ved konsultations-, hjemme- og døgnblodtryksmålinger. Blodtryk < 140/85 mmHg Man bør dog i nogle tilfælde sætte højere individuelle mål, f.eks. ved langvarig diabetes, høj biologisk alder, ortostatisme og behandlingsresistens, for at undgå bivirkninger. |
1.-valg: AT2-receptorantagonist (ARB) eller ACE-hæmmer (ACE-I)
Ved hypertension er førstevalgspræparatet ARB eller ACE-I. Pga. risikoen for hoste kan ARB foretrækkes frem for ACE-I.
Vær opmærksom på:
- Kalium og eGFR kontrolleres 3-4 uger efter behandlingsstart og dosisændring af ARB eller ACE-hæmmere.
- Ved behandlingsstart med ARB eller ACE-I ses ofte fald i eGFR. Hvis dette fald er under 30 %, kan behandlingen fortsætte. Falder eGFR mere end 30 %, overvejes væskestatus samt justering/ophør af medicin, der kan påvirke nyrefunktionen, som diuretika, antihypertensiva og NSAID (NB: håndkøbsforbrug).
- Ved stabilt niveau kontrolleres kalium og eGFR som minimum årligt.
- Hos patienter med svært nedsat nyrefunktion (eGFR < 30 ml/min/1,73 m2) skal man være opmærksom på dosisreduktion af ACE-I, der udskilles renalt. Det samme gør sig ikke gældende for ARB-præparaterne, der udskilles hepatisk. Konferer evt. med nefrolog.
2.- og 3.-valg: Calciumantagonist eller thiazid-diuretikum
Blandt (dihydropyridin-) calcium-antagonisterne er amlodipin førstevalg pga. pris, bivirkningsprofil, dokumentation og interaktioner. De forskellige (dihydropyridin-) calciumantagonister må i øvrigt indbyrdes betragtes som ligeværdige. Ved udvikling af ødemer under amlodipin-behandling kan lercanidipin forsøges. Blandt thiazid-diuretika anvendes ofte bendroflumetazid, alternativt hydrochlortiazid alene eller i kombinationspræparater. På grund af mulig risiko for hudkræft (7) ved behandling med hydrochlorthiazid foretrækkes bendroflumetazid.
Vær opmærksom på:
- eGFR, natrium og kalium kontrolleres før start, efter 1 måned og herefter 1-2 gange årligt.
4.- og 5.-valg: Beta-blokker, aldosteron-antagonist eller alfa-beta-blokker
Ved anvendelse af beta-blokker anbefales metoprolol.
Ved anvendelse af alfa-beta-blokker anbefales carvedilol.
Vær opmærksom på:
- Ved anvendelse af aldosteron-antagonist kontrolleres eGFR, natrium og kalium før start, efter 1 måned og herefter 1-2 gange årligt.
6.-valg: Moxonidin eller alfa-blokker
Vær opmærksom på:
- Ved anvendelse af moxonidin måles eGFR før start med henblik på dosisjustering.
Er blodtrykket mere end 150/90 mmHg initialt, kan behandlingen indledes med både 1.- og 2.-valg i kombination.Behandling med mere end 4-5 lægemidler vil ofte være en endokrinologisk, nefrologisk eller kardiologisk speciallægeopgave. Højt saltindtag i kosten kan øge blodtrykket og begrænser effekten på blodtryk af ARB/ACE-I, så saltreduktion er vigtig. Vær opmærksom på, at både GLP-1 RA og SGLT-2-hæmmere kan sænke blodtrykket.
Behandling med NSAID er kontraindiceret hos patienter med svær hypertension og skal anvendes med yderste forsigtighed ved nefropati, hjertesvigt og ikke mindst ved samtidig behandling med ARB/ACE-I. Dual-blokade med ACE-I og ARB anbefales ikke, og reninhæmmer bør ikke anvendes.
Særlige grupper:
- Ved isoleret systolisk hypertension eller angina pectoris kan med fordel vælges (dihydropyridin-) calciumantagonist.
- Ved hjertesvigt og/eller ødemer kan med fordel vælges et diuretikum.
- Ved makroalbuminuri med eGFR < 45 ml/min/1.73 m2 eller utilstrækkelig effekt af thiazid-diuretikum anbefales loop-diuretikum frem for thiazid.
- Ved tidligere myokardieinfarkt eller atrieflimmer kan med fordel vælges en beta-blokker.
- Ved hjertesvigt og albuminuri med terapiresistent hypertension kan med fordel anvendes spironolakton som tillæg til diuretika og ACE-I eller ARB. Kombinationen af lavdosis (12,5-25 mg) spironolakton og ACE-I eller ARB ved terapiresistent hypertension er især indiceret ved systolisk hjertesvigt og vedvarende albuminuri. Behandlingen kræver omhyggelig kontrol af elektrolytter og nyrefunktion. Kombinationen skal anvendes med forsigtighed ved eGFR < 45 ml/min/1.73 m2 og pauseres ved dehydrering eller risiko derfor.
- Finerenon (Kerendia) er en ny non-steroid aldosteron-antagonist med påvist nyre- og hjertebeskyttende effekt ved type 2 diabetes og kronisk nyresygdom med eGFR ≥25 ml/min/1,73 m2 og vedvarende albuminuri (≥ 30 mg/g) trods behandling med de for patienten maksimalt tolerable doser af ACE-hæmmer/ARB og SGLT2-hæmmer eller hvor SGLT2-hæmmer ikke tolereres/er kontraindiceret. (8, 9). Forekomsten af hyperkaliæmi ved tillæg til RAS-blokade er betydeligt mindre end for spironolakton og evidensen for hjerte-nyrebeskyttelse større; til gengæld er den blodtrykssænkende effekt betydeligt mindre (ca. 4 vs. 10 mm Hg). Se også nedenstående afsnit om albuminuri og nedsat nyrefunktion. Behandlingen skal iværksættes af eller konfereres med speciallæge i nefrologi eller endokrinologi
Farmakologisk behandling af albuminuri og nedsat nyrefunktion
Definitioner
Albuminuri er udtryk for nyrepåvirkning og kan forekomme med eller uden påvirket eGFR eller hypertension. Traditionelt er albuminuri blevet gradueret i mikro- og makroalbuminuri – en benævnelse man er ved at forlade til fordel for en inddeling i:
- Normal til let forhøjet albuminuri med urin-albumin/kreatinin-ratio < 30 mg/g
- Moderat forhøjet albuminuri med urin-albumin/kreatinin-ratio på 30-300 mg/g (=mikroalbuminuri)
- Svært forhøjet albuminuri med urin-albumin/kreatinin-ratio på 300 mg/g (=makroalbuminuri).
En forhøjet urin-albuminudskillelse skal konfirmeres ved mindst 2 målinger med 1 til 8 ugers mellemrum pga. den store intraindividuelle variabilitet i urin-albuminudskillelse (30-40 %) samt risiko for fejlkilder (herunder UVI og menstruation).
Rationale for behandling
Albuminuri (albumin/kreatinin-ratio ≥ 30 mg/g) og nedsat nyrefunktion (eGFR<60 ml/min/1,73 m2) er delvist uafhængige og additive risikofaktorer for nyresvigt, men også for hjertekarsygdom og død (1). Over tid udvikler omkring 40 % af alle patienter med type 2-diabetes en albumin/kreatinin-ratio ≥ 30 mg/g (mikroalbuminuri) og 5-10 % får albumin/kreatinin-ratio ≥ 300 mg/g (makroalbuminuri). Kronisk nyresygdom defineres som nedsat nyrefunktion og/eller albuminuri (≥ 30 mg/g) i mindst 3 måneder (1).
Rettidig opsporing og behandling af albuminuri kan forebygge progression og reducere risikoen for såvel nyre- som hjertekarsygdom og død (2-4). Den øgede udskillelse af albumin i urinen afspejler udbredt endotelskade i blodkarrene, som følge af hyperglykæmi og hypertension (5).
De seneste år er der kommet evidens fra store kardiovaskulære outcome-studier inkluderende en bred population af primært kardiovaskulært syge diabetespatienter med varierende grader af diabetisk nyrepåvirkning (6-9), men også dedikerede studier af diabetespatienter med kronisk nyresygdom med urin-albumin:kreatinin-ratio >200 mg/g og eGFR 20-90 ml/min/1,73 m2 (10;11,14). I disse populationer forebygger SGLT-2-hæmmere fald i eGFR samt nedsætter risiko for nyresvigt, blodpropper i hjerte og hjerne og død som følge af hjerte- eller nyresygdom. Det er vigtigt at bemærke, at selv om den glukosesænkende effekt af SGLT-2-hæmmere aftager kraftigt med faldende nyrefunktion, fastholdes den nyre- og hjertebeskyttende effekt i hvert fald ned til eGFR på 25 ml/min/1,73 m2, uafhængig af HbA1c og af, om patienten har diabetes (11). To uafhængige studier hos diabetespatienter med type 2 diabetes og kronisk nyresygdom med albuminuri≥30 mg/g og eGFR 25-90 ml/min/1,73 m2 har undersøgt den nonsteroide aldosteron-antagonist, finerenon, og vist reduktion i udvikling af nyresvigt og kardiovaskulær sygdom (især mindre forekomst af hospitalisering for hjertesvigt) (12). Subgruppeanalyser tyder på, at effekterne af SGLT2i og finerenon er additive, men der mangler studier mhp dette (13).
Det skal bemærkes at patienter med alene nedsat nyrefunktion (fald i eGFR) uden albuminuri (fx betinget af høj alder) formodentlig vil have en mindre absolut risikoreduktion ved brug af SGLT-2 hæmmer sammenlignet med patienter, som også har albuminuri. Ligeledes er evidensen for absolut risikoreduktion patienter med albuminuri ≥30-200 mg/g ikke lige så god som ved højere grader af albuminuri.
Behandlingsmål
Behandlingsmål for albuminuri
| At stabilisere og hindre progression af albuminurien og tab af nyrefunktion. |
Der er tale om en forebyggende behandling, hvor den forventede effekt hos den enkelte patient skal stå i et rimeligt forhold til bivirkninger ved behandlingen og patientens forventede restlevetid. Dette bør overvejes, inden ny behandling iværksættes og ved opfølgning på igangværende behandling.
Valg af behandling
Begynd behandling med en AT2-receptorantagonist (ARB) eller en ACE-hæmmer (ACE-I)
- Begynd behandling i maksimal tolereret dosis – også selvom BT ≤ 130/80 mm Hg. Effekten er dosisafhængig, så optitrering af dosis er vigtig. Se i øvrigt ovenstående afsnit om hypertensionsbehandling.
Tillæg SGLT-2-hæmmer uafhængigt af HbA1c
- SGLT-2-hæmmer bør gives ved albuminuri ≥300 mg/g (makroalbuminuri) eller ved albuminuri ≥30 mg/g (mikroalbuminuri) og eGFR < 60 ml/min/1,73 m2
- SGLT-2-hæmmer overvejes ved albuminuri ≥30 mg/g (mikroalbuminuri) og eGFR > 60 ml/min/1,73 m2 eller blot eGFR < 60 ml/min/1,73 m2 (svag evidens) SGLT-2-hæmmere anvendes såvel til patienter med eGFR ned til 45 ml/min/1,73 m2 med samtidig glukosesænkende effekt og ved eGFR 20-45 ml/min/1,73 m2, for den organbeskyttende effekt, selvom den glukosesænkende effekt her er minimal. Ved yderligere tab af nyrefunktion, kan behandlingen fortsætte indtil dialyse/transplantation.
Overvej GLP-1-receptor agonister (GLP1-RA)
- Såfremt SGLT-2-hæmmer ikke tolereres, eller ved behov for yderligere glukosereduktion overvejes tillæg af GLP1-RA.
Overvej aldosteronblokade ved vedvarende albuminuri
- Tillæg finerenon 10 mg til ACE-I eller ARB ved vedvarende albuminuri
- Finerenon er en ny non-steroid mineralocorticoid receptor (aldosteron-)antagonist, som har vist nyre- og hjertebeskyttende effekt ved type 2 diabetes og kronisk nyresygdom med eGFR ≥25 ml/min/1,73 m2 og vedvarende albuminuri (≥ 30 mg/g) trods behandling med de for patienten maksimalt tolerable doser af ACE-hæmmer/ARB og SGLT2-hæmmer eller hvor SGLT2-hæmmer ikke tolereres/er kontraindiceret. Opstart af finerenon behandling er primært en opgave for endokrinologer og nefrologer. Behandlingen er aktuelt godkendt som tillæg til RAS-blokade og SGLT2-hæmmer ved albuminuri ≥30 mg/g og eGFR 25-60 ml/min/1.73m2 (men kan formentlig bruges ved højere eGFR når FIGARO studiet er vurderet af EMA). Kalium skal være under 4,8 mmol/l (evt <5,0) når behandlingen startes (med 10 mg daglig), og den pauseres ved dehydrering eller risiko herfor og/eller ved kalium >5,5 mmol/l. Dosis øges til 20 mg daglig hvis kalium er under 4,8 mmol/l Behandling er forbundet med øget risiko for hyperkaliæmi, hvorfor eGFR og kalium kontrolleres før start, efter 1 måned og herefter 1-2 gange årligt. Finerenon er modsat spironolakton ikke associeret med gynækomasti og seksuelle bivirkninger, og forekomsten af hyperkaliæmi synes at være mindre ved finerenon end ved spironolakton. Randomiserede studier har ikke undersøgt hvorvidt kombinationen af SGLT2-hæmmer og finerenon har additiv gavnlig effekt på albuminurien.
Herudover optimeres den blodsukker-, lipid- og blodtrykssænkende behandling, og antitrombotisk behandling vil ofte være indiceret.
Monitorering af patienter med albuminuri
Albumin/kreatinin-ratio og eGFR følges hos patienter med albumin/kreatinin-ratio ≥ 30 mg/g (moderat forhøjet/mikroalbuminuri) med måneders interval, indtil albumin/kreatinin-ratioen er stabiliseret. Ved stabilisering af albuminurien måles albumin/kreatinin-ratio mindst en gang om året, mhp. at detektere evt. progression af albuminurien. Reduceres albuminurien, nedsættes risikoen for såvel nyre- som hjertekarsygdom og død (2-4).
Kriterier for henvisning til endokrinolog eller nefrolog kan variere med regionale og lokale forløbsprogrammer.
Ved stigende albumin/kreatinin-ratio, trods maksimal behandling med ARB eller ACE-I, kan man overveje kontakt til endokrinolog mhp. vejledning og evt. henvisning til ambulant forløb. Patienter med urin-albumin/kreatinin-ratio ≥ 300 mg/g (svært forhøjet/makroalbuminuri) bør som hovedregel vurderes i diabetesambulatorium.
Der henvises til nefrolog, når eGFR <30 ml/min/1,73m2, eller hvis der er et hastigt fald i nyrefunktionen (> 5 ml/min/1,73m2 pr år) eller ved svær albuminuri (albumin/kreatinin-ratio > 700 mg/g) ved mindst to målinger.
Farmakologisk behandling af dyslipidæmi
Rationale for behandling
Selvom type 2-diabetes typisk er ledsaget af dyslipidæmi med flere ændringer i lipidprofilen (lavt HDL-kolesterol, højt triglycerid), er særligt LDL-kolesterolniveauet associeret med den absolutte kardiovaskulære risiko og er derfor afgørende for behandlingsindikationen og behandlingsmål. Evidensen er hovedsagelig baseret på behandling med statiner (1-4), men der er tilkommet evidens for en effekt på den kardiovaskulære risiko af ezetimibe (5) og PCSK-9-hæmmere (6,7) i tillæg til statinbehandling.
Behandlingsmål
| LDL-kolesterol < 2,6 mmol/l og mindst 50 % reduktion fra udgangsniveau Patienter uden kendt hjerte-kar-sygdom eller øvrige risikofaktorer LDL-kolesterol < 1,8 mmol/l og mindst 50 % reduktion fra udgangsniveau Patienter med kendt cerebral iskæmi eller perifer arteriel insufficiens. Patienter med albuminuri, eGFR<60 ml/min/1.73 m2 eller ≥3 af følgende faktorer:
LDL-kolesterol < 1,4 mmol/l og mindst 50 % reduktion fra udgangsniveau Patienter med dokumenteret iskæmisk hjertesygdom. |
Valg af behandling
1.-valg
Begynd behandling med statin; atorvastatin 40 mg dagligt eller rosuvastatin 20 mg dagligt.
Atorvastatin og rosuvastatin kan øges til henholdsvis 80 og 40 mg ved behov for yderligere effekt. Ved diabetes og samtidig iskæmisk hjertesygdom anbefales det at behandle med maksimal dosis. Til patienter med nedsat eGFR anbefales primært atorvastatin.
Bivirkninger til statinbehandling
Forekomsten af bivirkninger til statinbehandling er meget lav. Myopati forekommer på placeboniveau i kliniske studier. Et nyligt studie (8) viste, at patienter, der angav at være statin-intolerante, ikke havde flere bivirkninger på behandling end på placebo.
Ved muskelsmerter (myalgi) uden klinisk betydningsfuld muskelenzymstigning anbefales derfor behandlingsforsøg med flere forskellige statiner (mindst 3) og i reducerede doser, inden man kan tale om reel statin-intolerans. I enkelte tilfælde med vedvarende symptomer kan man opnå et acceptabelt resultat med lave doser atorvastatin eller rosuvastatin nogle gange om ugen.
Vær opmærksom på:
Ved påbegyndelse af statinbehandling og ved dosisændring måles ALAT før behandling, efter en måneds behandling og derefter 1-2 gange årligt. Hvis koncentrationen stiger til mere end 3 gange øverste normale grænse, seponeres behandling.
Kreatininkinase måles før behandling ved prædisponerende faktorer for rhabdomyolyse (f.eks.ældre > 65 år, kvinder, nedsat nyrefunktion, ukontrolleret hypothyroidisme, alkoholmisbrug, arvelige muskulære sygdomme i familien). Måles desuden ved uforklarlige muskelsmerter. Hvis koncentrationen er mere end 4 gange øverste normalgrænse, bør behandlingen ikke påbegyndes/pauseres behandlingen, til muskelsymptomerne forsvinder. Behandlingen kan evt. genoptages ved lavest mulig dosis. Ved P-kreatinkinase > 10 gange øverste normalgrænse samt ved mistanke om rhabdomyolyse seponeres statinbehandlingen.
Øvrig lipidsænkende behandling
Der kan tilføjes ezetimibe 10 mg, hvis derehov for supplerende behandling for at nå behandlingsmålet.
Vær opmærksom på:
Ved mistanke om myopati eller ved kreatinkinase over 10 gange øverste normalgrænse skal ezetimibe seponeres.
Ved vedvarende svær hypertriglyceridæmi (triglycerid > 8-10 mmol/l) trods diæt, statinbehandling, regulation af hyperglykæmi og elimination af anden årsag (feks. alkohol, thyreotoxicose) kan der suppleres med fibrat(gemfibrozil). Kombination af fibrat og statin øger dog risikoen for bivirkninger, og kombination med simvastatin bør helt undgås.
Hvis LDL-målet ikke er opfyldt trods højdosis statin suppleret med ezetimibe, overvejes at tillægge en anionbytter,hvis man er tæt på behandlingsmålet (mangler 10-15 % LDL-reduktion), inden behandling med proprotein-konvertase-subtilisin/kexin-type 9 (PCSK-9) -hæmmer overvejes.
PCSK-9-hæmmer overvejes, hvis
- LDL-kolesterol > 3,0 mmol/l trods maksimal tolereret lipidsænkende behandling og diabetes med mikro-/makroalbuminuri.
- LDL-kolesterol > 2,6 mmol/l trods maksimal tolereret lipidsænkende behandling og diabetes med iskæmisk hjertesygdom, perifer arteriel sygdom eller iskæmisk apopleksi/TCI.
Der vil være en gruppe af patienter, som ikke har nået deres behandlingsmål, men som ikke vil opfylde kriterierne for PCSK-9-hæmmer-behandling.
Behandling med PCSK-9-hæmmere er dyr specialistbehandling og kan iværksættes via henvisning til specialafdeling i kardiologi eller endokrinologi, hvorfra medicinen udleveres.
Meget højt LDL (> 5 mmol/l) og behandlingsresistens skal give overvejelser om familiær hyperkolesterolæmi og henvisning til udredning på lipidklinikker. Ud over højt LDL taler en positiv familieanamnese, senexantomer, arcus cornae og xantelasmata for diagnosen.
Antitrombotisk behandling
Der er ikke evidens for primær profylakse til alle diabetespatienter (1), idet risikoen for bivirkninger, f.eks. blødning fra mave-tarm-kanalen, anses for at være betydelig.
Behandling med acetylsalicylsyre 75 mg/dag bør tilbydes diabetespatienter med:
- Hjerte-kar-sygdom og/eller nyresygdom (albuminuri, eGFR<60 ml/min/1.73 m2)
Behandling med acetylsalicylsyre 75 mg/dag overvejes til diabetespatienter med:
- Tre eller flere af følgende faktorer:
- Alder > 60 år
- Mandligt køn
- Familiær disposition til tidlig debut af kardiovaskulær sygdom (< 55 år for mænd, < 65 år for kvinder)
- Dysreguleret hypertension > 130/80 mmHg trods behandling
- Dyslipidæmi LDL > 1,8 mmol/l trods behandling
- Rygning > 10 pakkeår
Clopidogrel kan anvendes som alternativ, hvis acetylsalicylsyre ikke tåles.
Visitation
Som udgangspunkt diagnosticeres og følges patienter med T2DM i almen praksis. Kriterierne for hospitalshenvisning er:
- Mistanke om type 1 diabetes
- Svært regulerbar T2DM og/eller tendens til hypoglykæmi
- Behandlingsmålet kan ikke opnås i almen praksis med behov for kompleks behandling
- Signifikante komplikationer f.eks. fodproblemer, nefropati, svær retinopati (proliferativ og maculopati) og autonom neuropati.
- Graviditet og T2DM (se særskilt NBV)
Med PLO-overenskomsten 2017 for almen praksis er der lagt op til, at den praktiserende læge søger specialistrådgivning telefonisk eller via elektronisk korrespondance frem for og forud for henvisning.
Opfølgning
Der henvises til de regionale forløbsbeskrivelser for type 2 diabetes
APPENDIX
Farmakologisk behandling af specielle grupper
Patienter med diabetes og hjertekarsygdom/hjertesvigt
Definitioner
Hjerte-kar-sygdom omfatter iskæmisk hjertesygdom, cerebral iskæmi (apoplexi eller TCI) og perifer arteriel insufficiens (ankel-brachialindex mindre end 0.9).
Hjertesvigt omfatter hjertesvigt med nedsat pumpefunktion (HFrEF) (ejection fraction (EF) < 40 %) og hjertesvigt med bevaret pumpefunktion, men kliniske tegn på hjertesvigt (HFpEF).
Forekomst
Prævalensen af type 2-diabetes har de senere år været stigende, hvilket betyder, at et stort antal patienter lever med kroniske komplikationer. Dette er især tilfældet for hjerte-kar-sygdom, som findes hos > 100.000 personer med type 2-diabetes.
Samtidig er faldende incidensrater observeret for både hjerte-kar-sygdom, cerebrovaskulær sygdom, hjertesvigt og amputationer. Fra 1995-2017 er overdødeligheden i forhold til baggrundsbefolkningen uden diabetes faldet ca. 0,7 % per år (1).
Rationale for behandling
Der er i de senere år kommet en lang række store kardiovaskulære outcome-studier inkluderende en bred population af primært kardiovaskulært syge diabetespatienter. Disse har vist, at brug af SGLT-2-hæmmere og GLP-1 RA reducerer forekomsten af MACE (major adverse cardiovacular event defineret som nonfatal myokardieinfarkt, cerebral iskæmi eller kardiovaskulær død) (2-9), hjertesvigt med nedsat LVEF (10-12) og med bevaret pumpefunktion (13-15). Desuden er der vist reduktion i forekomsten af nonfatal iskæmisk stroke (16,17). For både SGLT-2-hæmmere og GLP-1 RA er effekterne på de kardiovaskulære endepunkter (inklusive hjertesvigt) uafhængige af HbA1c. Der mangler data for HbA1c-niveauer < 48 mmol/mol. Nedenfor gennemgås, hvilke stofgrupper som er indiceret hvornår, samt den kardiovaskulære profil.
Behandlingsmål
| HbA1c mellem 48-58 mmol/mol – Ved etableret hjerte-kar-sygdom og hjertesvigt anbefales generelt at stile mod HbA1c-niveau < 58 mmol/mol, individualiseret ud fra øvrige patienthensyn. – Dog skal en patient med nydiagnosticeret hjerte-kar-sygdom, som hidtil har været velbehandlet – uden hypoglykæmi – med lavt HbA1c-mål (< 53 mmol/mol) ikke reduceres i antiglykæmisk behandling alene på grund af nytilkommen hjerte-kar-sygdom. – Ved nydiagnosticeret diabetes hos patient med hjerte-kar-sygdom kan der godt stiles mod HbA1c < 53 mmol/mol, evt. lavere ved behandling i henhold til den generelle algoritme kombineret med livstilsændringer. Blodtryk < 130/80 mmHg LDL-kolesterol <1,4 mmol/l og mindst 50 % reduktion fra udgangsniveau. |
Behandlingsvalg
Ved iskæmisk hjertesygdom
En SGLT-2-hæmmer eller en GLP-1 RA skal foretrækkes uanset HbA1c-niveau. Implementering af SGLT-2-hæmmer/GLP-1 RA må ikke forsinkes af optitrering af metformin. Her kan metformin tillægges efter initiering af SGLT-2-hæmmer/GLP-1 RA. En patient, som allerede er i metforminbehandling, når hjertesygdom konstateres, skal som hovedregel fortsætte med denne, når man tillægger SGLT-2-hæmmer eller en GLP-1 RA uanset HbA1c niveau. Ved bivirkninger ved metformin eller ønske fra patientens side kan metformin dosis reduceres uden tab af dengavnlige effekt af SGLT-2-hæmmer og GLP-1-RA.
- SGLT-2-hæmmerne empagliflozin, dapagliflozin og canagliflozin sænker den kardiovaskulære risiko.
- GLP-1 RA liraglutid, semaglutid og dulaglutid sænker den kardiovaskulære risiko.
- DPP-4-inhibitorer og de nyere generationer af sulfonylurinstof, gliclazid og glimepirid har en neutral kardiovaskulær profil.
- Insulin har en neutral kardiovaskulær effekt.
Ved hjertesvigt
Nedenstående gælder både patienter med hjertesvigt med nedsat og bevaret pumpefunktion.
1.-valg af farmakologisk behandling er SGLT-2-hæmmer (Canagliflozin, Dapagliflozin og Empagliflozin). Implementering af SGLT-2-hæmmer må ikke forsinkes af optitrering af metformin. Her kan metformin tillægges efter initiering af SGLT-2-hæmmer. En patient, som allerede er i metforminbehandling, når hjertesvigt konstateres, skal som hovedregel fortsætte med denne (se ovenfor), men have tillagt SGLT-2-hæmmer uanset HbA1c niveau.
- GLP-1 RA har beskeden/ingen beskyttende effekt ved hjertesvigt. Grundet manglende erfaring frarådes GLP-1 RA ved udtalt hjertesvigt
- DPP-4-inhibitorer – dog fraset saxagliptin, som øger indlæggelse for hjertesvigt – har en neutral effekt.
- De nyere generationer af sulfonylurinstof (gliclazid og glimepirid) har en neutral effekt
- Insulin har neutral effekt, men kan give væskeretention
- Pioglitazon frarådes ved iskæmisk hjertesygdom på grund af risikoen for hjertesvigt, især i kombination med insulin
Ved cerebral iskæmi
Der er ingen studier med cerebral iskæmi som primært endepunkt. Patienter med cerebral iskæmi indgår i de store kardiovaskulære studiers kompositte endepunkter.
1.-valg af farmakologisk behandling er metformin i kombination med GLP-1 RA (semaglutid, dulaglutid). Dette ser ud til at reducere tilfælde af nonfatal cerebral iskæmi.
- SGLT-2-hæmmere ser ud til at have lille/ingen effekt på risikoen for nonfatal cerebral iskæmi.
- Der er ikke data på øvrige antidiabetika.
Ved perifer arteriel insufficiens
Der er ingen studier med perifer arteriel insufficiens som primært endepunkt. Patienter med perifer arteriel insufficiens indgår i de store kardiovaskulære studiers kompositte endepunkter.
1.-valg af farmakologisk behandling er metformin i kombination med SGLT-2-hæmmere eller GLP-1 RA. Der er for canagliflozin i et enkelt studie fundet øget forekomst af amputationer. Dette er ikke fundet i studier for øvrige SGLT-2-hæmmere.
- Der er ikke data på øvrige antidiabetika.
Monitorering
Hos alle voksne patienter med diabetes anbefales:
- Én gang årligt at spørge til kardiovaskulære symptomer (primært dyspnø, perifere ødemer og ubehag i brystet) samt opmærksomhed på fund af uregelmæssig puls i forbindelse med blodtrykskontrol.
- EKG på diagnosetidspunktet, ved kardiovaskulære symptomer og ved fund af uregelmæssig puls.
- Der mangler evidens for at anbefale rutinemæssig billeddiagnostisk screening for koronar hjertesygdom hos asymptomatiske diabetespatienter.
Ved kardiovaskulære symptomer, abnormt EKG eller anden mistanke om hjertesygdom henvises til hjerteafdeling eller kardiolog med henblik på nærmere undersøgelse.
Patienter med diabetes og nyresygdom
Definition
Nyresygdom klassificeres og gradueres ud fra et estimeret mål for den glomerulære filtrationsrate (eGFR), urin-albuminudskillelse og evt. andre bagvedliggende sygdomme ud over diabetes. Kronisk nyresygdom defineres som nedsat nyrefunktion (eGFR<60 ml/min/1,73 m2) og/eller albuminuri (≥ 30 mg/g) i mindst 3 måneder(1). Albuminuri (albumin/kreatinin-ratio ≥ 30 mg/g) og nedsat nyrefunktion (eGFR<60 ml/min/1,73 m2) er delvist uafhængige og additive risikofaktorer for nyresvigt, men også for hjertekarsygdom og død (1).
Tidligere skelnede man mellem diabetisk nyresygdom (moderat forhøjet/mikroalbuminuri) med samtidig ledsaget nedsat eGFR (under 60 ml/min/1,73 m2 og diabetisk nefropati (svært forhøjet albuminuri/makroalbuminuri uden anden oplagt årsag). Disse er nu erstattet af ovenstående definition på nyresygdom.
Der er dog fortsat tale om et kontinuum, hvor samtidig tilstedeværelse af både albuminuri og anden mikroangiopati (f,eks, retinopati) taler for diabetisk årsag til nyresygdom.
Det skal bemærkes at patienter med alene nedsat nyrefunktion (fald i eGFR) uden albuminuri (fx betinget af høj alder) formodentlig vil have en mindre absolut risikoreduktion ved brug af SGLT-2 hæmmer sammenlignet med patienter, som også har albuminuri. Ligeledes er evidensen for absolut risikoreduktion patienter med albuminuri ≥30-200 mg/g ikke lige så god som ved højere grader af albuminuri.
Nyrebiopsi er almindeligvis ikke påkrævet, men kan være indiceret ved kort diabetesvarighed, fravær af diabetisk retinopati og samtidig tegn på alvorlig nyresygdom eller eGFR under 60 ml/min/1,73 m2 i mere end tre måneder
Forekomst
Over tid udvikler 5-10 % af patienterne diabetisk nefropati (1), og der ses stigende incidensrater for kronisk nyresygdom hos diabetespatienter, som til dels kan skyldes en “healthy survivor“-effekt samt øget brug af RAS-blokade og SGLT-2-hæmmere. Ikke desto mindre er kronisk nyrepåvirkning et dårligt prognostisk tegn, der skal være opmærksomhed på.
Rationale for behandling
Se afsnit om farmakologisk behandling af hypertension samt albuminuri.
Behandlingsmål
| HbA1c 48-58 mmol/mol Patienter med diabetisk nefropati har øget risiko for hypoglykæmi, så blodglucose reguleres mindre stramt, hvis patienten behandles med insulin eller sulfonylurinstoffer. Blodtryk <130/80 mmHg Det generelle behandlingsmål for blodtrykket ved type 2-diabetes målt ved konsultations-, hjemme- og døgnblodtryksmålinger. Reduktion eller stabilisering af albuminurien samt bevarelse af nyrefunktion. |
Valg af behandling
Ved diabetisk nyresygdom søges behandlingen optimeret som beskrevet i afsnit om albuminuri.
Alle bør være i behandling med en AT2-receptorantagonist (ARB) eller en ACE-hæmmer (ACE-I) og optimeret lipid- og blodtrykssænkende behandling. Antitrombotisk behandling vil ofte være indiceret.
Alle uanset HbA1c tillægges en SGLT-2-hæmmer: SGLT-2-hæmmer bør gives ved albuminuri ≥300 mg/g (makroalbuminuri) eller ved albuminuri ≥30 mg/g (mikroalbuminuri) og eGFR < 60 ml/min/1,73 m2.SGLT-2-hæmmerovervejes ved albuminuri ≥30 mg/g (mikroalbuminuri) og eGFR > 60 ml/min/1,73 m2 eller blot eGFR < 60 ml/min/1,73 m2 (svag evidens)
SGLT-2-hæmmere anvendes såvel til patienter med eGFR ned til 45 ml/min/1,73 m2 med samtidig glukosesænkende effekt og kan overvejes ved eGFR 20-45 ml/min/1,73 m2, for den organbeskyttende effekt, selvom den glukosesænkende effekt her er minimal. Ved yderligere tab af nyrefunktion, kan behandlingen fortsætte indtil dialyse/transplantation.
Ved albuminuri ≥30 mg/g, eGFR 30-60 ml/min/1,73m2 og kalium <4,8 (evt <5,0) mmol/l trods RAS blokade og behandling med SGLT2-hæmmer anbefales tillæg af finerenon (eneste nonsteroide MRA med dokumenteret hjerte og nyrebeskyttende effekt).
Ved eGFR <60 ml/min/1,73 m2 skal der uanset albuminuri-status ved medicingennemgang være opmærksomhed på nefrotoksiske medikamenter (f,eks NSAID, lithium, radiologiske kontrastmidler og aminoglykosider). Medicin der udskilles uomdannet renalt, skal eventuelt dosisreduceres (f.eks metformin).
Figur 7: viser faldende nyrefunktion (eGFR) og daglig dosis for de mest anvendte antidiabetika. Lånt med tilladelse fra Dansk Nefrologisk Selskab fra rapporten ”Diabetisk nyresygdom ved type 2-diabetes; 2021”
Monitorering af patienter med diabetisk nyresygdom
Patienten med diabetisk nyresygdom følges med kontrol 1-2 gange årligt af
- blodprøve (eGFR, elektrolytter, Hgb)
- urin-albumin/kreatinin ratio
- blodtryk
- Vægt/vurdering af ødemer.
Kriterier for henvisning til endokrinolog eller nefrolog kan variere med regionale og lokale forløbsprogrammer.
Patienter med albumin/kreatinin-ratio ≥300 mg/g (makroalbuminuri) bør som hovedregel følges i diabetesambulatorium. Henvis til nefrolog, når eGFR er < 30 ml/min/1,73 m2, eller hvis der er et hastigt fald i nyrefunktionen (> 5 ml/min/1,73m2 pr år) eller ved betydelig, svær albuminuri (albumin/kreatinin-ratio 700 mg/g) ved mindst to målinger.
Patienter med diabetes og svær overvægt
Definition
Patienter med type 2-diabetes og svær overvægt (Body Mass Index (BMI) > 30kg/m2).
Forekomst
I Danmark har ca. 17 % af voksne svær overvægt og hos personer med type 2-diabetes har ca. 40 % svær overvægt (1).
Rationale for behandling
Studier har vist, at SGLT-2-hæmmer, GLP-1 RA og dual agonist princippet, GIP/GLP-1 RA, ud over at bedre den glykæmiske kontrol også besidder egenskaber, som reducerer kropsvægten og dermed bidrager yderligere til at forbedre den generelle metaboliske kontrol (2,3). Hovedparten af de studier, som er gennemført med patienter med type 2-diabetes og svær overvægt (gennemsnitlig BMI ca. 32 kg/m2), har vist, at GLP-1 RA og GIP/GLP-1 RA behandling er mere egnet til at bibringe såvel bedre glykæmisk kontrol som et vægttab, der er lidt større end f.eks. behandling med en SGLT-2-hæmmer.
Ud over anvendelse som antidiabetisk behandling er GLP-1 RA også tilgængelig under indikationen svær overvægt, i form af liraglutide (Saxenda). En nyere GLP-1 RA semaglutide (Wegowy) 2,4 mg ugenligt er godtkendt af lægemiddelmyndighederne og bliver markedsført i Danmark primo 2023. Dual agonist GIP/GLP-1 RA, tirzepatide afventer godkendelse af lægemiddelmyndighederne ift. indikationen svær overvægt.
Studier med liraglutide 3,0 mg dagligt (4) har demonstreret vægttab på ca. 8 % af udgangsvægten og studier med semaglutide 2,4 mg ugentlig har demonstreret vægttab op til ca. 15 % af udgangsvægten hos personer med svær overvægt uden følgesygdomme (5) og op til 10 % hos personer med svær overvægt og type 2-diabetes (6). Man skal være opmærksom på, at der ved ophør af behandling med semaglutide typisk ses øgning af vægten mod udgangspunktet (25) Hos patienter med type 2-diabetes og svær overvægt grad 2-3 (BMI over 35 kg/m2) kan man overveje at anvende semaglutide (Wegowy) 2,4 mg ugentlig eller liraglutide (Saxenda) 3 mg dagligt. Tilskud til behandling med semaglutide er endnu ikke fastlagt og det er fortsat svært at opnå individuelt tilskud til liraglutide på indikationen fedme. Dual agonist GIP/GLP-1 RA, tirzepatide (Mounjaro), har i et nyligt afsluttet studie hos personer uden type 2-diabetes med gennemsnitlig BMI 38 kg/m2, demonstreret vægttab op til 21 % af udgangsvægten (7). Hos personer med type 2 diabetes med gennemsnitligt BMI 32 kg/m2 og hba1c 63 mmol/mol, har behandling med tirzepatide tilsvarende demonstreret reduktion i HbA1c på ca. 20 mmol/mol og vægttab omkring 13% (8).
Ved indirekte sammenligning mellem GLP-1 RA (semaglutide 1 mg/uge) og SGLT-2-hæmmeren (empagliflozin 25 mg/dag) sås en gennemsnitlig forbedring i HbA1c på ca. 0,8 % (7 mmol/mol) og reduktion i kropsvægt på knap 2 kg i favør af semaglutide (9). Højere dosering af GLP-1 RA semaglutide (2 mg/uge), har sammenlignet med semaglutide 1 mg/uge, demonstreret bedre glykæmisk regulation med reduktion i HbA1c på hhv. 2,2 og 1,9 % og større vægttab på ca. 1 kg (10). Oral GLP-1 RA (semaglutide 14 mg daglig) reducerer HbA1c med gennemsnitligt 1,4 % (15 mmol/mol) og kropsvægten med godt 3 kg sammenlignet med placebo (11)
Modsat den subkutane GLP-1 RA (semaglutide), som i et studie har vist superiority (12), er den orale formulering af GLP-1 RA (semaglutide) i et andet studie non-inferior i forhold til et sammensat kardiovaskulært endepunkt (4).
Farmakologisk behandling
I forhold til kombinationen af type 2-diabetes og svær overvægt er følgende rationelt:
1.-valg er metformin.
2.-valg er GLP-1 RA og/eller SGLT-2-hæmmer
- GLP-1 RA-behandling giver ud over forbedret glykæmisk regulation også reduktion i kropsvægten på op til 5-6 kg sammenlignet med placebo.
- SGLT-2-hæmmer-behandling giver ud over forbedret glykæmisk regulation også reduktion i kropsvægten på 2-3 kg.
- GLP-1 RA (semaglutide 1 mg ugentlig) giver i tillæg til SGLT-2-hæmmer-behandling ud over forbedret glykæmisk regulation også yderligere reduktion i kropsvægten på ca. 4 kg.
- GLP-1 RA (semaglutide 2 mg) ugentlig giver sammenlignet med semaglutide 1 mg ugentlig forbedret glykæmisk regulation også yderligere reduktion i kropsvægten på ca. 1 kg.
- GIP/GLP-1 RA behandling giver hos personer med type 2 diabetes reduktion i kropsvægten på ca 13% og væsentlig forbedring i glykæmisk regulation.
Kirurgisk behandling
Såfremt medicinsk behandling ikke kan bibringe en tilstrækkelig glykæmisk kontrol hos patienter med type 2-diabetes og svær overvægt grad 2-3 (BMI over 35 kg/m2), kan man i Danmark henvise disse til vurdering om egnethed til bariatrisk kirurgi (13). De kirurgiske indgreb, som tilbydes i Danmark, er Roux-en-Y gastrisk bypass (RYGB) og Sleeve gastrektomi (SG) (14). Ved begge indgreb opnås relativt store og blivende vægttab med en gennemsnitlig reduktion på omkring 20-40 % af udgangsvægten, hvilket svarer til et absolut vægttab på 25-50 kg, hvor størrelse af vægttabet i absolut kg i det væsentligste er relateret til udgangsvægten (15). Af de to kirurgiske metoder er effekten af RYGB bedst dokumenteret, og der foreligger for denne procedure mere end 20 år post-operativ opfølgning, som dokumenterer bl.a. en reduceret mortalitet (16).
- Kirurgisk behandling (RYGB eller SG) giver i forhold til intensiv nonfarmakologisk plus intensiv farmakologisk behandling en betydelig forbedring i den glykæmiske regulation, inkl. remission af diabetes samt en reduktion i kropsvægten på ca. 20 % (17).
- Fem år efter bariatrisk kirurgi ses komplet remission (HbA1c < 42 mmol/mol i mindst 1 år; sv.t. American Diabetes Associations (ADA) kriterier) hos 43 % og partiel remission (HbA1c < 48 mmol/mol i mindst 1 år; sv.t. ADA’s kriterier) hos 51 %. Der ser ud til at være forskel på RYBG og SG, i RYGB’s favør, i forhold til at opnå både komplet og partiel diabetesremission postoperativt (18,19).
- Langtidsdata (over 5 år) hos patienter, som har gennemgået RYGB, viser, at 35-50 % af de patienter, som har haft remission, på et senere tidspunkt vil få behov for farmakologisk behandling af deres type 2-diabetes, men den gennemsnitlige tid i diabetesremission hos disse er ca. 8 år (20).
- Bariatrisk kirurgi hos patienter med insulinbehandlet type 2-diabetes og lang diabetesvarighed (over 10 år) har vist, at ca. 70 % af patienterne fortsat var uden insulinbehandling 4 år efter kirurgi (21).
Forbedring i glykæmisk regulation eller remission af type 2-diabetes menes at ske som en følge af selve vægttabet kombineret med ændringerne i de anatomiske forhold i mave-tarm-kanalen, hvor specielt tarmhormoner som f.eks. GLP-1 spiller en central rolle (22).
Det kan anbefales at overveje at henvise personer med type 2-diabetes og BMI over 35kg/m2 til kirurgisk vurdering.
Lang diabetesvarighed (over 8 år) og behandling med insulin bør haves in mente, da disse forhold er forbundet med nedsat chance for diabetesremission og større risiko for recidiv efter en opnået diabetesremission (20). Fem år efter et kirurgisk indgreb vil knap 90 % have oplevet én eller flere problemer i relation til det kirurgiske indgreb, men på trods af det rapporterer < 10 % af patienterne ringere selv-rapporteret helbred (23,24).
Monitorering efter fedmekirurgi
Patienter skal følges livsvarigt med regelmæssig kontrol og årlig status. Der henvises til Dansk Endokrinologisk guideline (https://endocrinology.dk/nbv/andre-endokrinologiske-sygdomme/non-kirurgisk-behandling-af-svaer-overvaegt/).
Patienter med diabetes og fremskreden alder
Definitioner
- De raske/uafhængige: Maksimalt 1-2 konkurrerende sygdomme ud over type 2-diabetes. Ingen funktionsbegrænsninger. Kognitivt intakt.
- De komplekse/skrøbelige: Tre eller flere konkurrerende lidelser og/eller lettere påvirkning af de kognitive funktioner.
- De svært syge: En eller flere af følgende: i slutstadiet af kronisk sygdom, moderat til svær demens, to eller flere funktionsnedsættelser. Mange plejehjemsbeboere, men der kan også være tale om patienter i eget hjem.
Rationale for behandling
Type 2-diabetes er hyppigt forekommende hos ældre (iflg. WHO er ældre personer ≥ 65 år), og disse patienter kræver særlig opmærksomhed. Høj kronologisk alder i sig selv giver dog ikke anledning til ændringer i principper for forebyggelse, diagnostik og behandling.
Begrebet skrøbelighed (”frailty”) bliver ofte benyttet i den internationale litteratur. Der eksisterer ikke nogen entydig dansk definition, men skrøbelighed kan beskrives som en tilstand med biologisk øget sårbarhed, hvor selv minimal belastning/stress kan medføre alvorlige funktionsproblemer. Skrøbelighed er ikke i sig selv funktionsbegrænsende, selv om mange skrøbelige personer har problemer med funktionsevne (1). Særlig opmærksomhed bør rettes mod de skrøbelige patienter, der på grund af fysisk eller mental svækkelse er i risiko for afhængighed af andre, faldtendens, nedsat mobilitet, vægttab, desorientering eller personlighedsændringer (2-5). Der vil ofte være behov for at ændre behandling, behandlingsmål og forventning til selvinddragelse i behandlingen.
Behandlingsmål
Hos de raske ældre kan man, i samråd med patienten, vælge at fastholde relativt stramme HbA1c-behandlingsmål, omkring < 53-58 mmol/mol, forudsat at patientens almentilstand ikke forværres, og at man kan undgå væsentlige bivirkninger, specielt hypoglykæmi. I denne gruppe kan det være nødvendigt at acceptere et højere blodtryksmål, f.eks. < 140/85 mmHg, for at undgå uhensigtsmæssige hændelser, herunder ortostatisme med risiko for fald. Behandling med lipidsænkende medicin kan fastholdes efter generelle anbefalinger, hvis det tolereres.
Hos de komplekse/skrøbelige ældre kan HbA1c-behandlingsmålet yderligere tillempes, < 64-69 mmol/mol. Her skal man være særlig opmærksom på symptomer på hyperglykæmi og akutte komplikationer som respons på dysregulering; dehydrering, nykturi, ringe sårheling og risiko for hyperosmolær hyperglykæmi. På linje med de raske ældre kan det være nødvendigt at acceptere et højere blodtryksmål, f.eks. < 140/85 mmHg, for at undgå uhensigtsmæssige hændelser, herunder ortostatisme med risiko for fald. Dog bør et BT < 130/80 mmHg fortsat tilstræbes hos visse højrisikopatienter, herunder patienter med tidligere stroke eller progredierende nyreinsufficiens, såfremt det lader sig gøre. Behandling med lipidsænkende medicin kan fastholdes efter generelle anbefalinger, hvis det tolereres. Ved behov for at reducere polyfarmaci hos ældre patienter med komplekse sygdomsbilleder kan seponering af statiner overvejes.
Hos de svært syge ældre er det primære mål symptomfrihed. Ved øget faldtendens kan man overveje at lægge behandlingsmålet for blodtrykket endnu højere, f.eks. ved < 150/90 mmHg. Når livets afslutning nærmer sig, kan symptomlindring være det eneste behandlingsmål. Hos patienter med kort forventet restlevetid er en gavnlig effekt af lipidsænkende behandling næppe sandsynlig, hvorfor fravalg af opstart eller eventuelt seponering af igangværende behandling må overvejes.
Endelig skal der udvises forsigtighed ved fortolkning af HbA1c hos ældre, eftersom der i denne population oftere forekommer komorbiditeter, der kan have indflydelse på erythrocytlevetiden, hvilket kan lede til en underestimering af den reelle værdi. Det gælder følgende tilstande: kronisk nyreinsufficiens, hæmodialyse, erythopoietin-behandling, anæmi, hæmoglobinopatier, nylig blodtransfusion eller hæmatologiske sygdomme.
Behandlingsmål fordelt på patientkarakteristika*
| Patientkarakteristika | Glykæmisk kontrol (HbA1c (mmol/mol)) | Blodtryk (mmHg) | Lipider |
| De raske | 53-58 | < 140/85 | Statinbehandling, hvis tolereret |
| De komplekse | <64-69 | < 140/85 | Statinbehandling, hvis tolereret |
| De svært syge | Undgå hypoglykæmi og symptomatisk hyperglykæmi | < 150/90 | Overvej fordele og ulemper |
| *Tabellen er en adaption af behandlingsmålstabellen udarbejdet af American Diabetes Association (ADA) og er en del af deres behandlingsvejledning af ældre med diabetes (4). | |||
Valg af behandling
Livsstilsintervention
Ældre diabetespatienter bør rådgives om livstilsintervention med baggrund i deres individuelle situation. Dog er der særlige forhold, der gør sig gældende hos ældre, som man bør være opmærksom på, eksempelvis:
- Er tyggefunktion, appetit og adgangen til mad tilstrækkelig?
- Er der tilstrækkeligt væskeindtag, så dehydrering undgås?
- Ved sondeernæring er der ofte store udsving i glukoseniveauer, der ofte kræver justering af den glukosesænkende behandling.
- Er der mulighed for tilpasset fysisk aktivitet?
Farmakologisk behandling
Mange ældre er storforbrugere af lægemidler, og hyppigheden af polyfarmaci (behandling med ≥ 5 lægemidler) stiger med alderen (54 % hos ≥ 75-årige) med deraf følgende øget risiko for medicinbivirkninger, interaktioner og manglende compliance. Ca. 10 % af alle sygehusindlæggelser af ældre kan relateres til uhensigtsmæssig medicinering. Ny medicin afprøves typisk blandt yngre, men anvendes ofte til de ældre, og der mangler ofte viden om virkninger og bivirkninger af mange af de kombinationer af lægemidler, som ældre behandles med. Det taler for tilbageholdenhed med lægemiddelbehandling af ældre, ikke mindst når det gælder forebyggelse af diabetiske følgesygdomme (15-17).
Overordnet behandles ældre efter den generelle behandlingsalgoritme, dog med særlig opmærksomhed på bivirkningsprofil ved valg af medicin. Den kardiovaskulære effekt af behandling med såvel GLP-1 som SGLT2 er gavnlig både for dem over 65 år og 75 år (10). DPP4 har udvist en neutral effekt på kardiovaskulære outcomes, uden en forskel i den yngre og ældre population (13-15). Statinbehandling er bedst undersøgt hos patienter under 75 år, men synes dog at reducere kardiovaskulær risiko relativt lige meget hos yngre og ældre patienter. Behandlingsmålene kan hos ældre reduceres ved bivirkninger. Det er generelt øget risiko for bivirkninger såsom myopati og rhabdomyolyse hos ældre over 70 år.
Ældre har øget risiko for alvorlig hypoglykæmi, og der er samtidig risiko for inadækvat reaktion på symptomer på hypoglykæmi. Det anbefales derfor at anvende glukosesænkende medikamenter med lav risiko for hypoglykæmi.
Bivirkninger hos ældre kan være diskrete, mindre karakteristiske og fejlagtigt blive tolket som forværring af eksisterende sygdom, tegn på ny sygdom eller udtryk for normal aldring.
Hyppige medicinbivirkninger hos ældre patienter med type 2-diabetes:
- Fald og svimmelhed: Øget risiko ved diuretika og antihypertensiva inkl. betablokkere (ortostatisk blodtryksfald, overbehandling og bradykardi). Brug af betablokker er uhensigtsmæssigt hos patienter med bradykardi (< 50/min), 2.-grads AV-blok eller 3.-grads AV-blok (risiko for 3.-grads AV-blok, asystoli). Ved initiering af SGLT-2-hæmmer bør evt. diuretika-dosis reduceres for at mindske risikoen for dehydrering.
- Kvalme, diarre, smagsforstyrrelser, vægttab og underernæring: Øget risiko ved f.eks. metformin og GLP-1 RA. Kan sekundært give dehydrering og faldtendens.
- Hypoglykæmi med fald, forvirring og risiko for koma: Øget risiko ved insulin og sulfonylurinstoffer, især dem med lang virkningsvarighed, f.eks. glimepirid). Gliclazid anbefales på grund af minimal risiko for hypoglykæmi. I forhold til insulin foretrækkes engangsdoseret langtidsvirkende præparater. Husk at revurdere dosis løbende.
- Betablokker kan maskere hypoglykæmisymptomer.
- Nedsat nyrefunktion og hyperkalæmi: Øget risiko ved ACE-I og ARB.
- Mavesmerter og mavesår: Øget risiko ved mange antidiabetika, specielt metformin samt acetylsalicylsyre.
- Forstoppelse: Øget risiko ved diuretika (dehydrering).
- Urinsyregigt: Øget risiko ved thiaziddiuretika.
- Træthed, forvirring og svækket hukommelse pga elektrolytforstyrrelser: Øget risiko ved thiaziddiuretika (hyponatriæmi og hypokalæmi). Volumen depletering er i nogle studier set mere hyppigt hos ældre, om end risikoen for akut nyresvigt stadig er reduceret ved SGLT2 behandling i denne gruppe (14-15).
- Genitale svampeinfektioner/UVI ved brug af SGLT-2-hæmmerbehandling synes muligvis være hyppigere hos ældre, der foreligger dog modstridende evidens (14-15).
- Muskelsmerter: Hos ældre over 75 år kan ved iskæmisk hjertekarsygdom overvejes at starte med Atorvastatin 40 mg eller Rosuvastatin 20 mg i modsætning til de maksimale doser, som iværksættes hos yngre patienter. Ved lav muskelmasse og øget risiko for bivirkninger må overvejes at starte statinbehandling i yderligere reduceret dosis. Ved behov for at reducere polyfarmaci hos ældre patienter med komplekse sygdomsbilleder kan seponering af statin overvejes.
Kompleksiteten af type 2-diabetes og betydelig komorbiditet hos ældre medfører ofte, at mange forskellige læger fra forskellige specialer og andre sundhedsfaglige kan være involveret i behandlingen af patienten. Det kræver et velfungerende samarbejde mellem patient, pårørende, almen praksis, hospitaler, praktiserende øjenlæger, fodterapeuter, diætister, den kommunale sygepleje og hjemmepleje.
Patienter med psykisk sygdom og risiko for diabetes
Definition og forekomst
Patienter med svær psykisk sygdom som skizofreni og bipolar lidelse har en betydelig øget risiko for udvikling af type 2-diabetes, der til dels hænger sammen med livsstil og dels med de psykofarmaka, der anvendes i behandlingen. Studier har endvidere vist en 40-60 % øget forekomst af diabetes ved depression.
Behandling af patienter med psykiske lidelser frembyder ofte særlige problemer. Sygdomme som f.eks. skizofreni og bipolære tilstande er forbundet med en betydelig overdødelighed med tab af 15-20 leveår. Somatiske lidelser, herunder metabolisk syndrom og diabetes spiller en væsentlig rolle og skyldes en kombination af genetisk disposition, underbehandling, uhensigtsmæssig livsstil med nedsat fysisk aktivitet og rygning, samt ikke mindst bivirkninger til psykofarmakologisk behandling. Studier fra bl.a. almen praksis har vist, at øget fokus på denne patientkategori kan reducere overdødeligheden.
En række meget anvendte psykofarmaka kan medføre vægtstigning og dermed øget risiko for diabetes.
| Høj risiko Ældre højdosis-typiske antipsykotika, clozapin og olanzapin Intermediær risiko Risperidon og quetiapin Lav risiko Aripiprazol, ziprasidon, lurasidon |
I en nylig vejledning fra Medicinerrådet (1) anbefales nu primært start af antipsykotika med en mere hensigtsmæssig metabolisk profil.
Herudover ses vægtøgning ved behandling med lithium, valproat, ved flere nyere antidepressiva som mianserin og mirtazepin, og ved ældre tricyliske antidepressiva.
Diabetisk ketoacidose og psykofarmaka
Diabetes præsenterer sig klinisk forskelligt hos patienterne, og særligt for psykiatriske patienter kan antipsykotika-betinget diabetisk ketoacidose (DKA) være den initiale sygdomsmanifestation. Årsagerne til DKA er multifaktoriel, men skyldes ofte manglende compliance under akut somatisk sygdom og omfatter svær hyperglykæmi, metabolisk acidose, dehydrering og elektrolytforstyrrelser. Mekanismen bag antipsykotisk-betinget DKA er ikke klarlagt, men er ofte karakteriseret ved debut kort efter påbegyndelse af antipsykotisk behandling og er derfor ikke udelukkende relateret til vægtøgning. HbA1c stiger ofte hurtigt, og en direkte effekt på betacellerne kan være en årsag. Mænd over 30 år er overrepræsenterede, og forløbet er præget af højere mortalitet end ved DKA hos patienter med type 1-diabetes. Information til patienterne om DKA-symptomer ved start af behandlingen er derfor vigtig, især ved præparater med høj risiko som olanzapin.
Valg af behandling
Patienter, der har fået konstateret diabetes, følges på vanlig vis med en årlig statusundersøgelse og mellemliggende kontrol efter behov. Behandling og behandlingsmål følger den generelle algoritme.
- -valg er metformin.
- Ved behov for supplerende 2.-valgs behandling anbefales anvendelse af SGLT-2 hæmmere og/eller GLP-1 RA på baggrund af den kardioprotektive og vægtreducerende effekt. Denne patientgruppe er dog ofte karakteriseret ved dårlig økonomi, hvorfor anden kombination med sulfonylurinstof (gliclazid og glimepirid) kan være et nødvendigt alternativ.
Monitorering af patienter i antipsykotisk behandling
Patienter, der påbegynder antipsykotisk behandling, kan med fordel tilbydes livsstilsintervention, som evt. kan foregå tværfagligt mellem psykiater, fysioterapeut, diætist og ergoterapeut, med udgangspunkt i den enkeltes tilstand og behov og afhængigt af de lokale tilbud. Patienten skal ved en årlig statusundersøgelse have målt vægt, taljeomfang, BT, lipider og HbA1c mhp. tidlig opsporing af diabetes. Såfremt der under den psykofarmakologiske behandling opstår forværring af type 2-diabetes, vægtøgning over 5 %, dyslipidæmi eller hypertension, kan præparatskift evt. overvejes i samråd med den behandlende psykiater.
Glukokortikoidbehandling og diabetes
Definitioner
Glukokortikoidinduceret diabetes: Morgen-blodsukker (BS) over 7 mmol/l eller vilkårligt BS over 11,1 mmol/l målt 2 dage i træk efter initiering af peroral steroidbehandling. Ofte vil det ikke-fastende BS eftermiddag/aften være er forhøjet grundet glukokortikoidernes farmakodynamik (1).
Bemærk, at HbA1c ikke benyttes i definitionen.
Forekomst
Incidensen af glukokortikoidinduceret diabetes opgøres fra 30 til 70 % med stigende incidens ved højere doser glukokortikoid (2,3). Størst udfordring ses ved langvarig (over 1 måned) systemisk steroidbehandling med høje doser (mere end 30 mg/dag i over 5 dage). Et andet problem er intermitterende højdosis steroidbehandling i forbindelse med cancer-kemoterapi, som indebærer forskellig behandling på steroiddage vs. ikke-steroiddage.
Rationale for behandling
Effekten på glukosemetabolismen er afhængig af det anvendte glukokortikoids farmakodynamiske egenskaber. Ved peroral prednisolonbehandling gives behandlingen typisk om morgenen, og glukoseniveauet følger derfor et typisk mønster med relativt lave glukoseværdier om morgenen, som stiger gradvist i løbet af dagen og forstærkes af måltiderne til en maksimal værdi midt på aftenen. Effekten når et maksimum ca. 12-16 timer efter prednisolondoseringen og falder betydeligt natten igennem. Heri ligger den største terapeutiske udfordring, hvis og når der er behov for farmakologisk behandling.
Behandlingsmål
Et præcist behandlingsmål er ikke defineret. En international guideline (6) anbefaler BS mellem 4-12 mmol/l, men det bør individualiseres baseret på alder og komorbiditet (f.eks. svært syge patienter eller terminale cancerpatienter). Et pragmatisk målblodsukker er mellem 5-15 mmol/l.
Valg af behandling
Overordnet er behandling af steroidinduceret diabetes præget af mangel på længerevarende randomiserede studier og god evidens. Særlig evidensen for behandling af middeldosis (10-30 mg prednisolon) er dårligt belyst.
Nedenstående forslag til behandlingsregimer og insulindoser er empirisk baseret og vil ofte passe til prednisolonbehandling givet oralt morgen (6). Gives prednisolondosis 2 gange dagligt, eller gives f.eks. dexametason, synes basalinsuliner med længere virkningsvarighed (f.eks. glargin fremfor NPH) at være en fordel (3). Behandlingen varetages af eller evt. i samråd med endokrinologer.
Behandlingsforslag er dels inddelt efter prednisolondoser og dels efter, om patienten har kendt diabetes. Der vil være lokale forskelle i, hvilket behandlingsregime som foretrækkes.
Lavdosis glukokortikoidbehandling (≤ 10 mg prednisolon dagligt)
Patienter med nyopstået steroidinduceret diabetes:
- Som udgangspunkt initieres i
- Tåles metformin ikke, kan sulfonylurinstof (gliclacid frem for glimepirid pga. halveringstiden) vælges som første præparat. Dog bør det ikke kombineres med insulinbehandling.
- Eventuelt tillæg af anden antidiabetika (sulfonylurinstof, DPP-4-hæmmere, GLP-1 RA, SGLT-2-hæmmere).
Patienter med allerede kendt diabetes:
- Ved initiering af lavdosis glukokortikoidbehandling intensiveres den antiglykæmiske behandling med tillæg af 1-2 glukosesænkende lægemidler, jf. behandlingsalgoritmen for type 2-diabetes. Er den glykæmiske kontrol ikke tilfredsstillende, påbegyndes insulinbehandling. I så fald seponeres evt. sulfonylurinstof.
Patienter med allerede kendt diabetes i insulinbehandling:
- Insulindosis øges afhængig af glukosemålingerne.
Højdosis glukokortikoidbehandling (mere end 30 mg prednisolon dagligt i mere end 5 dage)
Generelt:
- Patienten vil oftest have behov for insulinbehandling (både nyopstået steroidinduceret diabetes og kendt diabetes forværret af steroidbehandling).
- Der er ikke enighed om insulinregimer eller insulindoser, men grundet den udtalte insulinresistens anbefales at indlede morgendosis med humant isophaninsulin (NPH-insulin eller glargin 100) 0,2-0,3 enheder/kg, men ofte kan det være nødvendigt at øge til 0,5 enheder/kg. Bruges blandingsinsulin (f.eks. insulin aspart/insulin aspart protamin (f.eks. Novomix 30)), anbefales at initiere 0,3 enheder/kg om morgenen. Man kan hurtigt se, hvor insulinresistent patienten er, og kan derfor ofte titrere hurtigt op.
Afhængig af glukoseprofilen foreslås følgende:
Hos patienter i højdosis prednisolonbehandling med normal (nær-normal) faste-morgen-BS samt postprandiel BS over 15-25 mmol/l:
- Til tider kan man nøjes med hurtigtvirkende Insulin aspart præprandielt – doseringsforslag f.eks. 8 enheder morgen og frokost (titreret efter 4-punkts profil).
- Alternativt blandingsinsulin (Novomix 30) til morgen – doseringsforslag f.eks. 24 enheder morgen, svarende til 8 enheder hurtigtvirkende morgen. Man kan evt. vælge Novomix 30 til frokost i stedet.
- Alternativt NPH-insulin morgen (0,2-0,3 enheder/kg). Obs hypoglykæmi morgen ved for stor dosisøgning.
Hos patienter med forhøjet faste-BS (over 7 mmol/l) samt postprandielt over 15-25 mmol/l
- Novomix 30 til morgen eller basalinsulin morgen (NPH-insulin).
- Alternativt insulin glargine suppleret med Insulin aspart præprandielt til de tre hovedmåltider.
Brug af insulin aspart, som først ordineres postprandielt, synes ikke at være sufficient til at behandle hyperglykæmi (8). Ligeledes øges risikoen for hypoglykæmi, hvis insulin aspart gives uden for måltider.
Patienter, som før behandling med glukokortikoider, allerede er insulinbehandlede
- Insulindosis øges afhængig af glukosemålingerne. Ved højdosis steroidbehandling er der ofte behov for en dosisøgning på mere end 40 % og/eller mere tæt monitorering eller henvisning til diabetesambulatorium.
- Intensiveringen bør typisk være overgang fra basalinsulin til basal-bolus-regime eller blandingsinsulin 2 gange dagligt fremfor en simpel øgning i basalinsulin.
- Ved basal-bolus-regime, synes der ikke at være klinisk forskel på brug af de to regimer NPH-insulin /insulin aspart og insulin glargin/insulin aspart.
Aftrapning af steroidbehandling
Ofte ændres løbende i steroiddosisbehandling, og her er det vigtigt at regulere den antiglykæmiske behandling (særligt insulindoser) løbende, så hypoglykæmi undgås. Ved brat seponering af højdosis (> 30 mg/dag) glukokortikoid nedtrappes insulindosis, således at dosis reduceres med 30 % dag 2, 20 % dag 3 og herefter enten ophør eller hos patienter med vanlig insulindosis fortsættelse af denne. Nedtrappes prednisolondosis langsommere, vil de målte glukoseværdier være bestemmende for hastigheden i insulinnedtrapningen. Evt. vægtstigning og øget abdominal fedtfordeling efter længere tids steroidbehandling kan gøre, at den samlede glukosesænkende behandling bliver ændret, og man derfor ikke kan trappe helt ud af den glukosesænkende behandling /eller reducere til helt samme niveau som før steroidbehandlingen.
Udvikling af diabetes under glukokortikoidbehandling gør patienten disponeret for senere udvikling af regulær type 2-diabetes – også efter ophørt steroidbehandling. Disse patienter bør derfor én gang årligt screenes for diabetes med bestemmelse af HbA1c.
Opsporing og monitorering
Patienter, som planlægges behandlet med højdosis prednisolon, bør før opstart have målt HbA1c. Dette identificerer patienter i lav risiko (under 39 mmol/mol) og patienter med hidtil uerkendt diabetes (over 48 mmol/mol), som altid vil få stigende plasmaglukose og dermed behov for behandling.
- HbA1c under 39 mmol/mol.
- Ingen monitorering nødvendig ved kortvarig behandling (maks.x 4-5 dage). Ved længerevarende behandling (over 5 dage) monitoreres som nedenfor beskrevet.
- HbA1c 40 – 47 mmol/mol: BS måles optimalt sent eftermiddag/før aftensmåltid 2 gange ugentligt. Ved 2 tilfældigt målte BS-værdier over 11,1 mmol/l har patienten diabetes under glukokortikoidbehandlingen. Patienten oplæres i hjemme-blodsukkermåling.
- HbA1c over 48 mmol/mol: Patienten har kendt diabetes: BS måles som udgangspunkt x 4. Patienten oplæres i hjemme-blodsukkermåling.
Referencer
Referencer til indledende afsnit
- Snorgaard O, Drivsholm TO, Breum L et al. Farmakologisk behandling af type 2-diabetes – mål og algoritmer. 2011. http://www.dsam.dk/files/11/diabetesbehandling.pdf
- Lassen B, Christiansen JS, Lauritzen T et al. Insulinbehandling af patienter med type 2-diabetes. 2011. http://www.dsam.dk/files/11/diabetesbehandling.pdf
- Davies MJ, D’Alessio DA, Fradkin J, Kernan WN et al. Management of hyperglycaemia in type 2 diabetes, 2018. A consensus report by the American Diabetes Association (ADA) and the European Association for the Study of Diabetes (EASD). Diabetologia 2018; 61:2461-98.
- Davies MJ Aroda VR, Collins BS, Gabbay RA, Green J, Maruthur NM et al:Management of hyperglycaemia in type 2 diabetes, 2022. A consensus report by the American Diabetes Association (ADA) and the European Association for the Study of Diabetes (EASD). Diabetologia. 2022 Dec;65(12):1925-1966
- Sundhedsstyrelsen. Den Nationale rekommandationsliste. IRF 2020. Farmakologisk glukosesænkende behandling af type 2 diabetes.
- Medicinrådets rapport 2021
- Tuomilehto J, Lindström J, Eriksson JG, Valle TT, Hämälänen H et al. Prevention of type 2 diabetes mellitus by changes in lifestyle among subjects with impaired glucose tolerance. N Engl J Med 2001; 344(18):1343-50.
- Knowler WC, Barrett-Connor E, Foeler SE, Hamman RF, Lachin JM et al. Reduction in the incidence of type 2 diabetes with lifestyle intervention or metformin. N Engl J Med 2002; 346(6):393-403.
- Lean ME, Leslie WS, Barnes AC, Brosnahan N, Thom G et al. Primary care-led weight management for remission of type 2 diabetes (DiRECT); an open-label, cluster-randomised trial. Lancet 2018; 391(10120):541-51.
- The Look AHEAD Research Group. Cardiovascular effects of intensive lifestyle intervention in type 2 diabetes. N Engl J Med 2013; 369:145-54
- The Look AHEAD Research Group. Association of the magnitude of weight loss and changes in physical fitness with long-term cardiovascular disease outcomes in overweight or obese people with type 2 diabetes: a post-hoc analysis of the Look AHEAD randomized clinical trial. Lancet Diabetes Endocrinol 2016; 4: 913–21.
- Sundhedsstyrelsen.National klinisk retningslinje for udvalgte sundhedsfaglige indsatser ved rehabilitering til patienter med type 2 diabetes. 2015. www.sst.dk
Referencer til farmakologisk behandling af hyperglykæmi
- Effect of intensive blood-glucose control with metformin on complications in overweight patients with type 2 diabetes (UKPDS 34). UK Prospective Diabetes Study (UKPDS) Group. Lancet Lond Engl. 12. september 1998;352(9131):854–65.
- Buse JB, Wexler DJ, Tsapas A, Rossing P, Mingrone G, Mathieu C, m.fl. 2019 Update to: Management of Hyperglycemia in Type 2 Diabetes, 2018. A Consensus Report by the American Diabetes Association (ADA) and the European Association for the Study of Diabetes (EASD). Diabetes Care. 2020;43(2):487–93.
- Palmer SC, Tendal B, Mustafa RA, Vandvik PO, Li S, Hao Q, m.fl. Sodium-glucose cotransporter protein-2 (SGLT-2) inhibitors and glucagon-like peptide-1 (GLP-1) receptor agonists for type 2 diabetes: systematic review and network meta-analysis of randomised controlled trials. BMJ. 13. januar 2021;372:m4573.
Referencer til insulinbehandling
- Raz I, Mosenzon O. Early insulinization to prevent diabetes progression. Diabetes Care. august 2013;36 Suppl 2:S190-197.
- Khunti K, Alsifri S, Aronson R, Cigrovski Berković M, Enters-Weijnen C, Forsén T, m.fl. Rates and predictors of hypoglycaemia in 27 585 people from 24 countries with insulin-treated type 1 and type 2 diabetes: the global HAT study. Diabetes Obes Metab. september 2016;18(9):907–15.
- Miller ME, Bonds DE, Gerstein HC, Seaquist ER, Bergenstal RM, Calles-Escandon J, m.fl. The effects of baseline characteristics, glycaemia treatment approach, and glycated haemoglobin concentration on the risk of severe hypoglycaemia: post hoc epidemiological analysis of the ACCORD study. BMJ. 8. januar 2010;340:b5444.
- Frier BM. Hypoglycaemia in diabetes mellitus: epidemiology and clinical implications. Nat Rev Endocrinol. december 2014;10(12):711–22.
- Rodbard HW, Cariou B, Zinman B, Handelsman Y, Philis-Tsimikas A, Skjøth TV, m.fl. Comparison of insulin degludec with insulin glargine in insulin-naive subjects with Type 2 diabetes: a 2-year randomized, treat-to-target trial. Diabet Med J Br Diabet Assoc. november 2013;30(11):1298–304.
- Yki-Järvinen H, Bergenstal R, Ziemen M, Wardecki M, Muehlen-Bartmer I, Boelle E, m.fl. New insulin glargine 300 units/mL versus glargine 100 units/mL in people with type 2 diabetes using oral agents and basal insulin: glucose control and hypoglycemia in a 6-month randomized controlled trial (EDITION 2). Diabetes Care. december 2014;37(12):3235–43.
- Wysham C, Bhargava A, Chaykin L, de la Rosa R, Handelsman Y, Troelsen LN, m.fl. Effect of Insulin Degludec vs Insulin Glargine U100 on Hypoglycemia in Patients With Type 2 Diabetes: The SWITCH 2 Randomized Clinical Trial. JAMA. 4. juli 2017;318(1):45–56
- Rosenstock J, Cheng A, Ritzel R, Bosnyak Z, Devisme C, Cali AMG, m.fl. More Similarities Than Differences Testing Insulin Glargine 300 Units/mL Versus Insulin Degludec 100 Units/mL in Insulin-Naive Type 2 Diabetes: The Randomized Head-to-Head BRIGHT Trial. Diabetes Care. oktober 2018;41(10):2147–54.
- Philis-Tsimikas A, Klonoff DC, Khunti K, Bajaj HS, Leiter LA, Hansen MV, m.fl. Risk of hypoglycaemia with insulin degludec versus insulin glargine U300 in insulin-treated patients with type 2 diabetes: the randomised, head-to-head CONCLUDE trial. Diabetologia. april 2020;63(4):698–710.
Referencer farmakologisk behandling af blodtryk
- Patel A, ADVANCE Collaborative Group, MacMahon S, Chalmers J, Neal B, Woodward M, m.fl. Effects of a fixed combination of perindopril and indapamide on macrovascular and microvascular outcomes in patients with type 2 diabetes mellitus (the ADVANCE trial): a randomised controlled trial. Lancet. 8. september 2007;370(9590):829–40.
- Xie X, Atkins E, Lv J, Bennett A, Neal B, Ninomiya T, m.fl. Effects of intensive blood pressure lowering on cardiovascular and renal outcomes: updated systematic review and meta-analysis. Lancet. 30. januar 2016;387(10017):435–43.
- Böhm M, Schumacher H, Teo KK, Lonn EM, Mahfoud F, Mann JFE, m.fl. Achieved blood pressure and cardiovascular outcomes in high-risk patients: results from ONTARGET and TRANSCEND trials. Lancet. 3. juni 2017;389(10085):2226–37.
- ACCORD Study Group, Cushman WC, Evans GW, Byington RP, Goff DC, Grimm RH, m.fl. Effects of intensive blood-pressure control in type 2 diabetes mellitus. N Engl J Med. 29. april 2010;362(17):1575–85.
- Blood Pressure Lowering Treatment Trialists’ Collaboration. Pharmacological blood pressure lowering for primary and secondary prevention of cardiovascular disease across different levels of blood pressure: an individual participant-level data meta-analysis. Lancet. 1. maj 2021;397(10285):1625–36.
- Williams B, Mancia G, Spiering W, Agabiti Rosei E, Azizi M, Burnier M, m.fl. 2018 ESC/ESH Guidelines for the management of arterial hypertension. Eur Heart J. 1. september 2018;39(33):3021–104.
- Pedersen SA, Gaist D, Schmidt SAJ, Hölmich LR, Friis S, Pottegård A. Hydrochlorothiazide use and risk of nonmelanoma skin cancer: A nationwide case-control study from Denmark. J Am Acad Dermatol. april 2018;78(4):673-681.e9.
- Bakris GL, Agarwal R, Anker SD, Pitt B, Ruilope LM, Rossing P, Kolkhof P, Nowack C, Schloemer P, Joseph A, Filippatos G; FIDELIO-DKD Investigators:
Effect of Finerenone on Chronic Kidney Disease Outcomes in Type 2 Diabetes. N Engl J Med. 2020 Dec 3;383(23):2219-2229. - Agarwal R, Filippatos G, Pitt B, Anker SD, Rossing P, Joseph A, Kolkhof P, Nowack C, Gebel M, Ruilope LM, Bakris GL; FIDELIO-DKD and FIGARO-DKD investigators. Cardiovascular and kidney outcomes with finerenone in patients with type 2 diabetes and chronic kidney disease: the FIDELITY pooled analysis. Eur Heart J. 2022 Feb 10;43(6):474-484.
Referencer til farmakologisk behandling af albuminuri og nedsat nyrefunktion
- Kidney Disease: Improving Global Outcomes (KDIGO) Diabetes Work Group. KDIGO 2020 Clinical Practice Guideline for Diabetes Management in Chronic Kidney Disease. Kidney Int. oktober 2020;98(4S):S1–115.
- de Zeeuw D, Remuzzi G, Parving H-H, Keane WF, Zhang Z, Shahinfar S, m.fl. Proteinuria, a target for renoprotection in patients with type 2 diabetic nephropathy: lessons from RENAAL. Kidney Int. juni 2004;65(6):2309–20.
- de Zeeuw D, Remuzzi G, Parving H-H, Keane WF, Zhang Z, Shahinfar S, m.fl. Albuminuria, a therapeutic target for cardiovascular protection in type 2 diabetic patients with nephropathy. Circulation. 24. august 2004;110(8):921–7.
- Persson F, Bain SC, Mosenzon O, Heerspink HJL, Mann JFE, Pratley R, m.fl. Changes in Albuminuria Predict Cardiovascular and Renal Outcomes in Type 2 Diabetes: A Post Hoc Analysis of the LEADER Trial. Diabetes Care. april 2021;44(4):1020–6.
- Deckert T, Feldt-Rasmussen B, Borch-Johnsen K, Jensen T, Kofoed-Enevoldsen A. Albuminuria reflects widespread vascular damage. The Steno hypothesis. Diabetologia. april 1989;32(4):219–26.
- Wanner C, Inzucchi SE, Lachin JM, Fitchett D, von Eynatten M, Mattheus M, Johansen OE, Woerle HJ, Broedl UC, Zinman B, Investigators E-RO. Empagliflozin and Progression of Kidney Disease in Type 2 Diabetes. N Engl J Med 2016;375:323-334.
- Neal B, Perkovic V, Mahaffey KW, de Zeeuw D, Fulcher G, Erondu N, Shaw W, Law G, Desai M, Matthews DR, Group CPC. Canagliflozin and Cardiovascular and Renal Events in Type 2 Diabetes. N Engl J Med 2017;377:644-657.
- Wiviott SD, Raz I, Bonaca MP, Mosenzon O, Kato ET, Cahn A, Silverman MG, Zelniker TA, Kuder JF, Murphy SA, Bhatt DL, Leiter LA, McGuire DK, Wilding JPH, Ruff CT, Gause-Nilsson IAM, Fredriksson M, Johansson PA, Langkilde AM, Sabatine MS, Investigators D-T. Dapagliflozin and Cardiovascular Outcomes in Type 2 Diabetes. N Engl J Med 2019;380:347-357.
- Cherney DZI, Charbonnel B, Cosentino F, Dagogo-Jack S, McGuire DK, Pratley R, Shih WJ, Frederich R, Maldonado M, Pong A, Cannon CP, Investigators VC. Effects of ertugliflozin on kidney composite outcomes, renal function and albuminuria in patients with type 2 diabetes mellitus: an analysis from the randomised VERTIS CV trial. Diabetologia 2021;64:1256-1267.
- Perkovic V, Jardine MJ, Neal B, Bompoint S, Heerspink HJL, Charytan DM, Edwards R, Agarwal R, Bakris G, Bull S, Cannon CP, Capuano G, Chu PL, de Zeeuw D, Greene T, Levin A, Pollock C, Wheeler DC, Yavin Y, Zhang H, Zinman B, Meininger G, Brenner BM, Mahaffey KW, Investigators CT. Canagliflozin and Renal Outcomes in Type 2 Diabetes and Nephropathy. N Engl J Med 2019;380:2295-2306.
- Heerspink HJL, Stefansson BV, Correa-Rotter R, Chertow GM, Greene T, Hou FF, Mann JFE, McMurray JJV, Lindberg M, Rossing P, Sjostrom CD, Toto RD, Langkilde AM, Wheeler DC, Committees D-CT, Investigators. Dapagliflozin in Patients with Chronic Kidney Disease. N Engl J Med 2020.
- Agarwal R, Filippatos G, Pitt B, Anker SD, Rossing P, Joseph A, Kolkhof P, Nowack C, Gebel M, Ruilope LM, Bakris GL; FIDELIO-DKD and FIGARO-DKD investigators. Cardiovascular and kidney outcomes with finerenone in patients with type 2 diabetes and chronic kidney disease: the FIDELITY pooled analysis. Eur Heart J. 2022 Feb 10;43(6):474-484.
- Rossing P, Burgess E, Agarwal R, Anker SD, Filippatos G, Pitt B, Ruilope LM, Gillard P, MacIsaac RJ, Wainstein J, Joseph A, Brinker M, Roessig L, Scott C, Bakris GL; FIDELIO-DKD Investigators: Finerenone in Patients With Chronic Kidney Disease and Type 2 Diabetes by Sodium-Glucose Cotransporter 2 Inhibitor Treatment: The FIDELITY Analysis.Diabetes Care. 2022 Apr 1;45(4):888-897
- EMPA-KIDNEY Collaborative Group; Herrington WG, Staplin N, Wanner C, Green JB, Hauske SJ et al: Empagliflozin in Patients with Chronic Kidney Disease. N Engl J Med. 2022 Nov 4. Online ahead of print
Referencer til farmakologisk behandling af dyslipidæmi
- Cholesterol Treatment Trialists’ (CTT) Collaborators. The effect of lowering LDL cholesterol with statin therapy in people at low risk of vascular disease: meta.analysis of individual data from 27 randomised trials. Lancet 2012; 380:581-90.
- de Vries FM, Kolthof J, Postma MJ, et al. Efficacy of standard and intensive statin treatment for the secondary prevention of cardiovascular and cerebrovascular events in diabetes patients: A meta-analysis. PloS ONE 2014; 9(11):e111247
- de Vries FM, Denig P, Pouwels KB et al. Primary prevention of major cardiovascular and cerebrovascular events with statins in diabetic patients. A meta-analysis. Drugs 2012; 72(12):2365-73.
4. Silverman MG, Ference BA, Kyungah I et al. Association between lowering LDL-C and cardiovascular risk reduction among different therapeutic interventions. A systematic review and meta-analysis. JAMA 2016; 316(12):1289-97. - Giugliano R, Cannon C, Blazing MA, Nicolau JC, Corbalán R et al. Benefit of adding ezetimibe to statin therapy on cardiovascular outcomes and safety in pati ents with versus without diabetes melleitus. Circulation 2018; 137:1571-82.
- Sabatine MS, Leiter LA, Wiviott SD et al. Cardiovascular safety and efficacy of the PCSK9 inhibitor evolocumab in patients with and without diabetes and the effect of evolocumab on glycemia and the risk of new-onset diabetes: aprespecified analysis of the FOURIER randomized controlled trial. Lancet Diabetes Endocrinol 2017; 5(12):941-50.
- Ray KK, Colhoun HM, Szarek M, Baccara-Dinet M, Bhatt DL et al. Effects of alirpcumab on cardiovascular and metabolic outcomes after acute coronary syndrome in patients with or without diabetes: a prespecified analysis of the ODYSSEY OUTCOME randomized controlled trial. Lancet Diabetes Endocrinol 2019; 7:618-28.
- Herrett E, Williamson E, Brack K, Beaumont D, Perkins A, Thayne A, m.fl. Statin treatment and muscle symptoms: series of randomised, placebo controlled n-of-1 trials. BMJ. 24. februar 2021;372:n135.
Referencer til antitrombotisk behandling
1.De Berardis G, Sacco M, Strippoli GFM, Pellegrini F, Graziano G et al. Aspirin for primary prevention of cardiovascular events in people with diabetes: meta-analysis of randomized controlled trials. BMJ 2009; 339:b4531
Referencer til patienter med diabetes og hjerte-karsygdom/hjertesvigt
- Jørgensen ME et al: Diabetes demography, cardiometabolic risk factors, and acute- and chronic diabetes complications in a nationwide diabetes registry in Denmark; Steno Diabetes Center Copenhagen 2020
- Neal B, Perkovic V, Mahaffey KW, de Zeeuw D, Fulcher G, Erondu N, m.fl. Canagliflozin and Cardiovascular and Renal Events in Type 2 Diabetes. N Engl J Med. 17. august 2017;377(7):644–57
- Zinman B, Wanner C, Lachin JM, Fitchett D, Bluhmki E, Hantel S, m.fl. Empagliflozin, Cardiovascular Outcomes, and Mortality in Type 2 Diabetes. N Engl J Med. 26. november 2015;373(22):2117–28.
- Wiviott SD, Raz I, Bonaca MP, Mosenzon O, Kato ET, Cahn A, m.fl. Dapagliflozin and Cardiovascular Outcomes in Type 2 Diabetes. N Engl J Med. 24. januar 2019;380(4):347–57.
- Furtado RHM, Bonaca MP, Raz I, Zelniker TA, Mosenzon O, Cahn A, m.fl. Dapagliflozin and Cardiovascular Outcomes in Patients With Type 2 Diabetes Mellitus and Previous Myocardial Infarction. Circulation. 28. maj 2019;139(22):2516–27.
- Marso SP, Daniels GH, Brown-Frandsen K, Kristensen P, Mann JFE, Nauck MA, m.fl. Liraglutide and Cardiovascular Outcomes in Type 2 Diabetes. N Engl J Med. 28. juli 2016;375(4):311–22.
- Gerstein HC, Colhoun HM, Dagenais GR, Diaz R, Lakshmanan M, Pais P, m.fl. Dulaglutide and cardiovascular outcomes in type 2 diabetes (REWIND): a double-blind, randomised placebo-controlled trial. Lancet Lond Engl. 13. juli 2019;394(10193):121–30.
- Marso SP, Bain SC, Consoli A, Eliaschewitz FG, Jódar E, Leiter LA, m.fl. Semaglutide and Cardiovascular Outcomes in Patients with Type 2 Diabetes. N Engl J Med. 10 2016;375(19):1834–44.
- Husain M, Birkenfeld AL, Donsmark M, Dungan K, Eliaschewitz FG, Franco DR, m.fl. Oral Semaglutide and Cardiovascular Outcomes in Patients with Type 2 Diabetes. N Engl J Med. 29. august 2019;381(9):841–51.
- Rådholm K, Figtree G, Perkovic V, Solomon SD, Mahaffey KW, de Zeeuw D, m.fl. Canagliflozin and Heart Failure in Type 2 Diabetes Mellitus: Results From the CANVAS Program. Circulation. 31. juli 2018;138(5):458–68.
- McMurray JJV, Solomon SD, Inzucchi SE, Køber L, Kosiborod MN, Martinez FA, m.fl. Dapagliflozin in Patients with Heart Failure and Reduced Ejection Fraction. N Engl J Med. 21. november 2019;381(21):1995–2008.
- Packer M, Anker SD, Butler J, Filippatos G, Ferreira JP, Pocock SJ, m.fl. Effect of Empagliflozin on the Clinical Stability of Patients With Heart Failure and a Reduced Ejection Fraction: The EMPEROR-Reduced Trial. Circulation. 26. januar 2021;143(4):326–36.
- Cosentino F, Cannon CP, Cherney DZI, Masiukiewicz U, Pratley R, Dagogo-Jack S, m.fl. Efficacy of Ertugliflozin on Heart Failure-Related Events in Patients With Type 2 Diabetes Mellitus and Established Atherosclerotic Cardiovascular Disease: Results of the VERTIS CV Trial. Circulation. 8. december 2020;142(23):2205–15.
- Anker SD, Butler J, Filippatos G, Ferreira JP, Bocchi E, Böhm M, Brunner-La Rocca H-P et al. Empagliflozin in heart failure with a preserved ejection fraction. N Engl J Med. 2021;385(16):1451–1461.
- Solomon SD, McMurray JJV, Claggett B, de Boer RA, DeMets D, Hernandez AF, Inzucchi SE et al; Dapagliflozin in Heart Failure with Mildly Reduced or Preserved Ejection Fraction. N Engl J Med 2022; 387:1089-1098
- Marso SP, Bain SC, Consoli A, Eliaschewitz FG, Jódar E, Leiter LA et al. Semaglutide and Cardiovascular Outcomes in Patients with Type 2 Diabetes. N Engl J Med. 10 2016;375(19):1834–44.
- Gerstein HC, Colhoun HM, Dagenais GR, Diaz R, Lakshmanan M, Pais P et al. Dulaglutide and cardiovascular outcomes in type 2 diabetes (REWIND): a double-blind, randomised placebo-controlled trial. Lancet Lond Engl. 13. juli 2019;394(10193):121–30.
Referencer til patienter med diabetes og nyresygdom
1 Jørgensen ME et al: Diabetes demography, cardiometabolic risk factors, and acute- and chronic diabetes complications in a nationwide diabetes registry in Denmark; Steno Diabetes Center Copenhagen 2020
Referencer til patienter med diabetes og svær overvægt
- https://www.sst.dk/da/Udgivelser/2022/Danskernes-sundhed
- Brown E et al SGLT2 inhibitors and GLP-1 receptor agonists in type 2 diabetes mellitus and obesity: Mechanistic possibilities; Obes Rev. 2019 Jun;20(6):816-828
- Frías JP, Davies MJ, Rosenstock J, Manghi FCP, Landó LF, Bergman BK et al for the SURPASS-2 Investigators*: Tirzepatide versus Semaglutide Once Weekly in Patients with Type 2 Diabetes. N Engl J Med 2021 Aug 5;385(6):503-515
- Astrup A, Carraro R, Finer N, Harper A, Kunesova M, Lean MEJ et al. NN8022-1807 Investigators: Safety, tolerability and sustained weight loss over 2 years with the once-daily human GLP-1 analog, liraglutide Int J Obes (Lond) 2012;36:843–54.
- Wilding JPH, Batterham RL, Calanna S, Davies M, Gaal LFV, Lingvay I et al. STEP 1 Study Group: Once-Weekly Semaglutide in Adults with Overweight or Obesity. N Engl J Med 2021 Mar 18;384(11):989-1002.
- Davies M, Færch L, Jeppesen OK, Pakseresht A, Pedersen SD, Perreault L, Rosenstock J et al STEP 2 Study Group: Semaglutide 2·4 mg once a week in adults with overweight or obesity, and type 2 diabetes (STEP 2): a randomised, double-blind, double-dummy, placebo-controlled, phase 3 trial. Lancet 2021 Mar 13;397(10278):971-984
- Jastreboff AM, Aronne LJ, Ahmad NN, Wharton S, Connery L, Alves B et al SURMOUNT-1 Investigators: Tirzepatide Once Weekly for the Treatment of Obesity. N Engl J Med. 2022 Jul 21;387(3):205-216)
- Rosenstock J, Wysham C, Frías JP, Kaneko S, Lee CJ, Landó LF et al: Efficacy and safety of a novel dual GIP and GLP-1 receptor agonist tirzepatide in patients with type 2 diabetes (SURPASS-1): a double-blind, randomised, phase 3 trial. Lancet 2021 Jul 10;398(10295):143-155
- Lingvay I, Capehorn MS, Catarig A, Johansen P, Lawson J, Sandberg A, Shaw R, Paine A.: Efficacy of Once-Weekly Semaglutide vs Empagliflozin Added to Metformin in Type 2 Diabetes: Patient-Level Meta-analysis. J Clin Endocrinol Metab.. 2020 Dec 1;105(12): e4593–e4604.
- Frías JP, Auerbach P, Bajaj HS, Fukushima Y, Lingvay I, Macura S et al: Efficacy and safety of once-weekly semaglutide 2·0 mg versus 1·0 mg in patients with type 2 diabetes (SUSTAIN FORTE): a double-blind, randomised, phase 3B trial. Lancet Diabetes Endocrinol 2021 Sep;9(9):563-574
- Aroda VA Rosenstock J, Terauchi Y, Altuntas Y, Lalic NM, Villegas ECM et al PIONEER 1 Investigators: PIONEER 1: Randomized Clinical Trial of the Efficacy and Safety of Oral Semaglutide Monotherapy in Comparison With Placebo in Patients With Type 2 Diabetes. Diabetes Care. 2019;42(9):1724‐1732
- Jódar E, Michelsen M, Polonsky W, Réa R, Sandberg A, Vilsbøll T et al: Semaglutide improves health-related quality of life versus placebo when added to standard of care in patients with type 2 diabetes at high cardiovascular risk (SUSTAIN 6) (Diabetes Obes Metab. 2020 Aug; 22(8): 1339–1347)
- Husain M, Birkenfeld AL, Donsmark M, Dungan K, Eliaschewitz FG, Franco DR et al. Oral Semaglutide and Cardiovascular Outcomes in Patients with Type 2 Diabetes; N Engl J Med. 2019 Aug 29;381(9):841-851
- https://www.sst.dk/da/nyheder/2017/~/media/A6FEE3C0A3AE4FE0B37206B2488D7FF7.ashx
- Syn NL, Cummings DE, Wang LZ, Lin, Beng DJL, Zhao JJ Loh M et al. Association of metabolic-bariatric surgery with long-term survival in adults with and without diabetes: a one-stage meta-analysis of matched cohort and prospective controlled studies with 174 772 participants. Lancet. 2021 May 15;397(10287):1830-1841.
- https://www.sst.dk/da/udgivelser/2017/~/media/F012C263031D411BA45982CB13B19589.ashx
- Carlsson LMS, Sjöholm K, Jacobson P, Andersson-Assarsson JC, Svensson PA, Taube M et al. Life Expectancy after Bariatric Surgery in the Swedish Obese Subjects Study; N Engl J Med. 2020 Oct 15;383(16):1535-1543
- Schauer PR, Bhatt DL, Kirwan JP, Wolski K, Aminian A, Brethauer SA et al. Bariatric Surgery versus Intensive Medical Therapy for Diabetes – 5-Year Outcomes; N Engl J Med. 2017 Feb 16;376(7):641-651
- Castellana M, Procino F, Biacchi E, Zupo R, Lampignano L, Castellana F et al. Roux-en-Y Gastric Bypass vs Sleeve Gastrectomy for Remission of Type 2 Diabetes; J Clin Endocrinol Metab. 2021 Mar 8;106(3):922-933
- Borgeraas H, Hofsø D, Hertel JK, Hjelmesaeth J. Comparison of the effect of Roux-en-Y gastric bypass and sleeve gastrectomy on remission of type 2 diabetes: A systematic review and meta-analysis of randomized controlled trials; Obes Rev. 2020 Jun;21(6):e13011
- Rubino F, Nathan DM, Eckel RH, Schauer PR, Alberti KGMM, Zimmet PZ. Metabolic Surgery in the Treatment Algorithm for Type 2 Diabetes: A Joint Statement by International Diabetes Organization; Diabetes Care. 2016 Jun;39(6):861-77
- McGlone ER, Carey I, Veličković V, Chana P, Mahawar K, Batterham RL. Bariatric surgery for patients with type 2 diabetes mellitus requiring insulin: Clinical outcome and cost-effectiveness analyses; PLoS Med. 2020 Dec 7;17(12): e1003228
- Holst JJ, Madsbad S. Mechanisms of surgical control of type 2 diabetes: GLP-1 is key factor; Surg Obes Relat Dis. 2016 Jul;12(6):1236-42
- Gribsholt SB, Pedersen AM, Svensson E, Thomsen RW, Richelsen B. Prevalence of Self-reported Symptoms After Gastric Bypass Surgery for Obesity; JAMA Surg. 2016 Jun 1;151(6):504-11
- Rubino D, Abrahamsson N, Davies M, Hesse D, Greenway FL, Jensen C, Lingvay I, Mosenzon O et al: STEP 4 Investigators: Effect of Continued Weekly Subcutaneous Semaglutide vs Placebo on Weight Loss Maintenance in Adults With Overweight or Obesity: The STEP 4 Randomized Clinical Trial. JAMA 2021 Apr 13;325(14):1414-1425.
Referencer patienter med diabetes og fremskreden alder
- Vass M, Hendriksen C. [In Denmark, there is a lack of consensus in the definition of frailty]. Ugeskrift for laeger. 2016;178(43).
- Oxlund C JJ, Christensen K.L. , Bang L. E , Pareek M, Hecht M. Arteriel hypertension 2021 [updated 10 Maj 2021; cited 2021 23 june]. Available from: https://nbv.cardio.dk/hypertension.
- Meneilly GS, Knip A, Miller DB, Sherifali D, Tessier D, Zahedi A. Diabetes in Older People. Canadian journal of diabetes. 2018;42 Suppl 1:S283-s95.
- Older Adults: Standards of Medical Care in Diabetes—2021. Diabetes care. 2021;44(Supplement 1):S168-S79.
- Cardiovascular Disease and Risk Management: Standards of Medical Care in Diabetes-2021. Diabetes care. 2021;44(Suppl 1):S125-s50.
- Sinclair AJ, Abdelhafiz A, Dunning T, Izquierdo M, Rodriguez Manas L, Bourdel-Marchasson I, et al. An International Position Statement on the Management of Frailty in Diabetes Mellitus: Summary of Recommendations 2017. The Journal of frailty & aging. 2018;7(1):10-20.
- 7.Schernthaner G, Grimaldi A, Di Mario U, Drzewoski J, Kempler P, Kvapil M, et al. GUIDE study: double-blind comparison of once-daily gliclazide MR and glimepiride in type 2 diabetic patients. European journal of clinical investigation. 2004;34(8):535-42.
- 8.Leiter LA, Teoh H, Braunwald E, Mosenzon O, Cahn A, Kumar KM, et al. Efficacy and safety of saxagliptin in older participants in the SAVOR-TIMI 53 trial. Diabetes care. 2015;38(6):1145-53.
- Karyekar CS, Ravichandran S, Allen E, Fleming D, Frederich R. Tolerability and efficacy of glycemic control with saxagliptin in older patients (aged ≥ 65 years) with inadequately controlled type 2 diabetes mellitus. Clinical interventions in aging. 2013;8: 419-30.
- Karagiannis T, Tsapas A, Athanasiadou E, et al. GLP-1 receptor agonists and SGLT2 inhibitors for older people with type 2 diabetes: A systematic review and meta-analysis. Diabetes research and clinical practice 2021; 174: 108737.
- 11 J. B. Green, M. A. Bethel, P. W. Armstrong, J. B. Buse, S. S. Engel, J. Garg, et al. Effect of Sitagliptin on Cardiovascular Outcomes in Type 2 Diabete N Engl J Med 2015 Vol. 373 Issue 3 Pages 232-42
- L. A. Leiter, H. Teoh, E. Braunwald, O. Mosenzon, A. Cahn, K. M. Kumar, et al Efficacy and safety of saxagliptin in older participants in the SAVOR-TIMI 53 trial. Diabetes Care 2015 Vol. 38 Issue 6 Pages 1145-53
- W. B. White, C. P. Cannon, S. R. Heller, S. E. Nissen, R. M. Bergenstal, G. L. Bakris, et al. Alogliptin after acute coronary syndrome in patients with type 2 diabetes. N Engl J Med 2013 Vol. 369 Issue 14 Pages 1327-35
- Cahn A, Mosenzon O, Wiviott SD, Rozenberg A, Yanuv I, Goodrich EL, et al. Efficacy and Safety of Dapagliflozin in the Elderly: Analysis From the DECLARE-TIMI 58 Study. Diabetes care. 2020;43(2):468-75.
- Monteiro P, Bergenstal RM, Toural E, Inzucchi SE, Zinman B, Hantel S, et al. Efficacy and safety of empagliflozin in older patients in the EMPA-REG OUTCOME® trial. Age Ageing. 2019;48(6):859-66.
Referencer til patienter med psykisk sygdom og risiko for diabetes
- Medicinrådets behandlingsvejledning vedrørende antipsykotika til behandling af psykotiske tilstande hos voksne, juli 2020
Referencer til glukokortikoidbehandling og diabetes
- Burt MG, Willenberg VM, Petersons CJ, Smith MD, Ahern MJ, Stranks SN. Screening for diabetes in patients with inflammatory rheumatological disease administered long-term prednisolone: a cross-sectional study. Rheumatol Oxf Engl. juni 2012;51(6):1112–9.
- Delfs N, Struja T, Gafner S, Muri T, Baechli C, Schuetz P, m.fl. Outcomes of Hospitalized Patients with Glucocorticoid-Induced Hyperglycemia-A Retrospective Analysis. J Clin Med. 17. december 2020;9(12).
- Radhakutty A, Burt MG. MANAGEMENT OF ENDOCRINE DISEASE: Critical review of the evidence underlying management of glucocorticoid-induced hyperglycaemia. Eur J Endocrinol. 1. oktober 2018;179(4):R207–18.
- Liu X, Zhu X, Miao Q, Ye H, Zhang Z, Li Y-M. Hyperglycemia induced by glucocorticoids in nondiabetic patients: a meta-analysis. Ann Nutr Metab. 2014;65(4):324–32.
- Zylla D, Gilmore G, Eklund J, Richter S, Carlson A. Impact of diabetes and hyperglycemia on health care utilization, infection risk, and survival in patients with cancer receiving glucocorticoids with chemotherapy. J Diabetes Complications. april 2019;33(4):335–9.
- Roberts A, James J, Dhatariya K, Joint British Diabetes Societies (JBDS) for Inpatient Care. Management of hyperglycaemia and steroid (glucocorticoid) therapy: a guideline from the Joint British Diabetes Societies (JBDS) for Inpatient Care group. Diabet Med J Br Diabet Assoc. august 2018;35(8):1011–7.
- Pernicova I, Kelly S, Ajodha S, Sahdev A, Bestwick JP, Gabrovska P, m.fl. Metformin to reduce metabolic complications and inflammation in patients on systemic glucocorticoid therapy: a randomised, double-blind, placebo-controlled, proof-of-concept, phase 2 trial. Lancet Diabetes Endocrinol. april 2020;8(4):278–91.
- Tatalovic M, Lehmann R, Cheetham M, Nowak A, Battegay E, Rampini SK. Management of hyperglycaemia in persons with non-insulin-dependent type 2 diabetes mellitus who are started on systemic glucocorticoid therapy: a systematic review. BMJ Open. 1. juni 2019;9(5):e028914.
Tovholder
Oprettet: 2011
Senest revideret: Oktober 2022
Næste revision: Oktober 2024
Øvrige forfattere:
Jette Kolding Kristensen1
Kirubakaran Balasubramaniam1
Morten Bjerregaard-Andersen2
Leif Breum2
Morten Charles1
Lars Jørgen Hansen1
Urd Kielgast2
Vanja Kosjerina2
Gitte Krogh Madsen1
Jens Meldgaard Bruun2
Dorte Navntoft1
Anna Pietraszek2
Peter Rossing2
Jørgen Rungby2
Morten Sig Jensen1
Ole Snorgaard2
Jacob Volmer Stidsen2
Esben Søndergaard2
Søren Tang Knudsen2
[1] Dansk Almen Medicinsk Selskab (DSAM) og Foreningen af Yngre Almen Medicinere (FYAM)
[2] Dansk Endokrinologisk Selskab (DES)