Definition
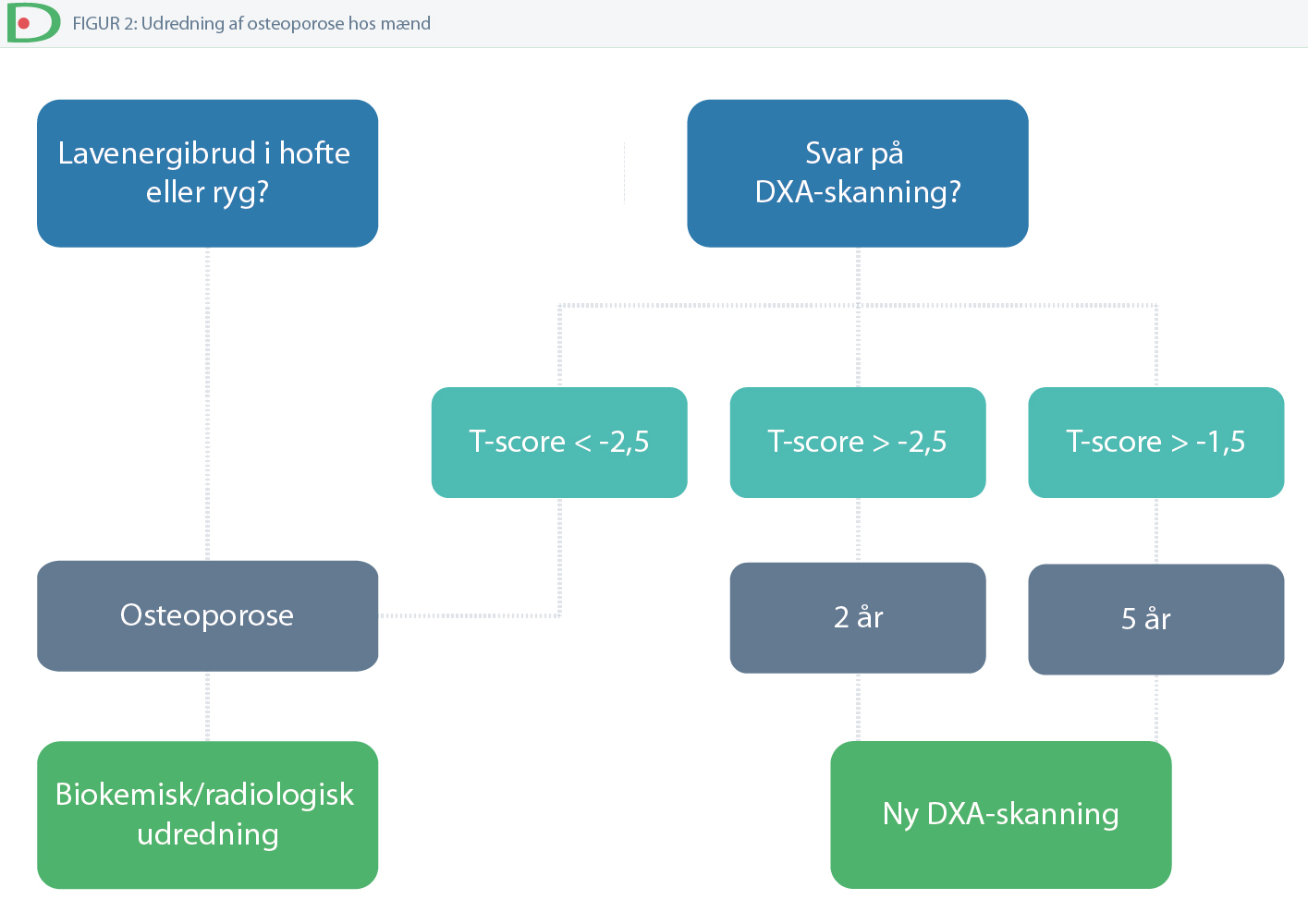
Osteoporose defineres ved en T-score under -2.5 (hofte og/eller ryg) og/eller en lavenergifraktur i hoften eller ryg. Se figur 1.
International konsensus for valget af behandlingsgrænse hos mænd savnes. Hvis man anvender et kønsspecifikt referencemateriale, er risikoen for fraktur ved en given T-score lavere hos mænd end hos kvinder. DES foretrækker en diagnostisk beslutningsgrænse svarende til det kvindelige referenceområde også hos mænd. Behandlingsindikationen afhænger af en samlet vurdering af BMD og summen af øvrige risikofaktorer.
Diagnosekoder
- M80.5 Idiopatisk osteoporose med patologisk fraktur
- M80.9 Osteoporose UNS med patologisk fraktur
- M81.5. Idiopatisk osteoporose
- M81.9 Osteoporose UNS
- M82.1. Osteoporose ved endokrin sygdom
- M82.8. Osteoporose ved andre sygdomme klassificeret andetsteds
Forekomst
Hver femte danske mand over 50 år har osteoporose, og cirka hver femte mand over 50 år vil pådrage sig et knoglebrud i den resterende livstid. For mænd, som har haft et osteoporotisk knoglebrud, er risikoen for nye knoglebrud lige så høj som hos kvinder med et osteoporotisk knoglebrud. Mortalitetsraten i det første år efter et hoftebrud er dobbelt så høj hos mænd som kvinder.
Ætiologi
Årsagerne til osteoporose hos mænd og kvinder adskiller sig principielt ikke væsentligt. Der henvises til tabel 1.
Andelen af ptt med sekundær osteoporose – herunder såvel primær som sekundær hypogonadisme – er dog større i en population af mandlige osteoporosepatienter end i en tilsvarende population af kvindelige osteoporosepatienter.
| Tabel 1. Risikofaktorer for osteoporose og osteoporotiske knoglebrud | |
| Familiær disposition til osteoporose | |
| Monogenetiske sygdomme | Osteogenesis Imperfecta Ehlers-Danlos syndrom Marfans syndrom |
| Immobilisering | |
| Fandtendens | |
| Mangeltilstande (Calcium, vitamin D) | |
| Endokrine og hormonelle årsager | Hypogonadisme Primær hyperparathyreoidisme Hyperthyreoidisme Akromegali og væksthormonmangel Cushings syndrom Addisons sygdom Diabetes type 1 og 2 |
| Rygning | |
| Alkoholoverforbrug | |
| Leversygdom | |
| Farmaka | Kortikosteroider (≥ 5 mg/dag i 3 måneder eller mere inden for 1 år). Se NBV: Glukokorticoid-induceret osteoporose Aromatase inhibitorer Anti-androgener En række lægemidler, eksempelvis visse anticonvulsiva, loop diuretika, lithium, heparin, warfarin, SSRI, TCA og glitazoner, er associeret med lav knoglemasse og/eller fraktur. Behandling med disse lægemidler giver ikke i sig selv indikation for udredning eller behandling. |
| Inflammatoriske reumatologiske lidelser | Rheumatoid arthritis Spondylitis ancylopoietica Systemisk lupus erythematosus Juvenil arthritis |
| Nedsat nyrefunktion | |
| Gastroenterologiske lidelser | Coeliaki Perniciøs anæmi Inflammatoriske tarmsygdomme Malabsorption Anoreksi/Bulimi |
| Svær, kronisk obstruktiv lungesygdom (COLD) | |
| Hæmatologiske sygdomme | Myelomatose Mastocytose |
| Organtransplantation | |
Sekundær osteoporose – herunder såvel primær som sekundær hypogonadisme – er betydeligt hyppigere hos mænd.
Symptomer og kliniske fund
Der synes ikke at være forskel på manifestationerne af osteoporose hos mænd og kvinder. Underarmsbrud er dog generelt sjældne hos mænd.
Udredning
Anamnese
Bør omfatte følgende: Arvelig disposition til osteoporose og lavenergibrud hos såvel far som mor og søskende, tidligere lavenergifrakturer, rygning og alkoholforbrug, faldtendens, immobilisation, medicinsk behandling, herunder særligt systemisk behandling med corticosteroid, og tilstedeværelse af sygdom, der øger risikoen for osteoporose (tabel 1)
Osteoporose hos mænd < 60 år er en specialistopgave, med mindre der foreligger en oplagt årsag, f.eks. langvarig steroidbehandling
DXA skanning
Udredning for osteoporose omfatter DXA skanning. Indikationerne for DXA skanning er anført i tabel 2.
| Tabel 2. DXA skanning bør foretages i følgende situationer |
| Mænd > 50 år med en risikofaktor |
| Mænd med arvelig disposition i lige linie |
| Nytilkomne rygsmerter forenelig med kompressionsfraktur, højdereduktion |
| Faldtendens |
| Stort alkohol- og/eller tobaksforbrug |
| Tidligere lavenergifraktur |
| Sygdom associeret med lav knoglemasse (tabel 1) |
| Mænd > 80 uden risikofaktor |
| Lægemidler associeret med tab af knoglemasse (tabel 1) |
| Ved vurdering af behandlingseffekt |
Vertebrale frakturer
Undersøgelse for mulige vertebrale kompressionsfrakturer med røntgen eller Vertebral Fracture Assessment (VFA) bør udføres i følgende situationer
- Rygsmerter forenelig med muligt sammenfald (dvs. pludseligt opståede)
- tab af mindst 4 cm i legemshøjden siden ungdommen (eller hvor der prospektivt er registreret en reduktion på mindst 2 cm)
- nedsat crista-costaafstand (< 2 fingersbredder)
- vurdering af vertebralt sammenfald påvist ved MR-skan
Ved længervarende rygsmerter foretrækkes røntgen fremfor VFA
Ved differentialdiagnostisk mistanke om anden patologi (metastaser, spinalstenose mv.) tilrådes det at henvise til MR-scanning
Fejlkilder: se venligst behandlingsvejledningen for Osteoporose
Biokemi
Hos mænd med nydiagnosticeret osteoporose anbefales biokemisk udredning omfattende HgB, TRC, LKC. CRP eller SR. Na, K, Crea/eGFR. BASP, ALAT. TSH. PTH og vitamin D (25-OHD), testosteron, LH, FSH
Udvalgte tilfælde
Ved columnafraktur: M-komponent i plasma og morgenurin (eller anden koncentreret spoturin) samt immunoglobuliner. Alternativt til urin M-komponent bestemmes frie lette kæder
Ved mistanke om malabsorption: Transglutaminaseantistoffer, magnesium og evt. laktoseintolerans-gentest.
Osteoporose med vertebrale sammenfald og mistanke om cancer prostata: PSA
Ved mistanke om mastocytose: Tryptase Eller KIT-mutation
Særlige kommentarer
Testosteron:
Med hensyn til måling og fortolkning af niveauet af testosteron i serum henvises til behandlingsvejledningen for mandlig hypogonadisme
Knoglemarkører:
Kan anvendes til at monitorere effekten på knogleomsætningen af antiresorptive lægemidler. CTx er i reglen supprimeret ved behandling med bisfosfonater efter 8 uger og efter få dage ved behandling med denosumab. P1NP er først lavest efter 3-6 måneder. Teriparatid medfører stigning i P1NP, som er højest efter ca. 3 måneder.
Betydningen af knoglemarkører for klinisk praksis er ikke endelig afklaret. Fravær af fald i markører svarende til least significant change i forhold til baseline eller manglende suppression til nedre normalområde for unge raske kvinder under behandling kan være forklaret af problemer med compliance, adherence, frakturer, sekundær osteoporose eller reelt fravær af effekt. Måling af CTx og/eller P1NP kan derfor bruges til at monitorere, om den ønskede effekt er opnået.
CTx skal måles fastende inden kl. 10 om morgenen
Fald
Der anbefales henvisning til faldudredning ved anamnese med
- 2 eller flere fald i det forudgående år
- fald med samtidig bevidsthedstab
- et forudgående fald med samtidig gang/balanceproblemer
Absolut frakturrisiko
Den absolutte 10 års frakturrisiko kan beregnes som en FRAX-score (www.shef.ac.uk/FRAX/). Bemærk, at knoglemineralindholdet (BMD) i lårbenshalsen skal anvendes. FRAX er begrænset valideret hos mænd og desuden underestimerer FRAX frakturrisikoen hos patienter, der har haft flere frakturer, hvor T-score er lavere i andre regioner og hvor der er tendens til fald. FRAX kan ikke anvendes til at monitorere behandlingseffekt. Hvis patienten har binyrebarkhormoninsufficiens, skal steroid (f.eks hydrokortison) ikke indregnes som en risikofaktor i FRAX-scoren. FRAX kan indtil videre kun anvendes som et beregningsredskab og kan ikke erstatte den kliniske vurdering, og benyttelsen af FRAX modellen i klinisk praksis udgør ikke en golden standard.
Behandling
Beskrivelse af de medicinske behandlinger af osteoporose er omtalt nedenfor. For en fuldstændig beskrivelse af lægemidlerne inklusiv bivirkninger, se www.medicin.dk.
Antiresorptiv behandling
Randomiserede, placebokontrollerede studier med fraktur som primært eller sekundært endepunkt har demonstreret, at visse bisfosfonatbehandlinger (alendronat, risedronat, zoledronsyre) nedsætter risikoen for vertebrale og hoftefrakturer hos mænd med osteoporose. Virkningen er af samme størrelsesorden som hos kvinder.
RANKLigand-hæmmeren denosumab kan anvendes til behandling af osteoporose hos mænd. Det er ikke undersøgt, om denosumab nedsætter risikoen for knoglebrud hos mænd med osteoporose.
Anabol behandling
Teriparatid (1-34 PTH) kan anvendes til behandling af osteoporose hos mænd over 40 år.
Behandling med anabolt lægemiddel skal være iværksat af en speciallæge i endokrinologi, rheumatologi, geriatri eller intern medicin.
Romosozumab er indtil videre ikke godkendt til behandling af osteoporose hos mænd
Valg af præparat
Førstevalgspræparater hos mænd er de peroral bisfosfonater alendronat og risedronat, mens de øvrige lægemidler typisk bruges, såfremt der er kontraindikationer, bivirkninger eller manglende behandlingsrespons på perorale bisfosfonater.
Ved svær osteoporose (T-score <-3 og ét vertebralt sammenfald > 25% eller 2 vertebrale sammenfald > 25%) kan anvendes anabol behandling.
Vurdering af behandling
Behandlingseffekt vurderes med fornyet DXA-skanning efter 2-3 år. Ved tilfredsstillende effekt (stabile BMD-værdier og ingen nytilkomne frakturer) fortsættes behandlingen med ny vurdering efter i alt 5 år.
Behandlingsvarighed
Varighed af behandling med antiresorptive lægemidler er uafklaret. Risikoen for sjældne, men alvorlige bivirkninger som kæbenekrose og atypiske subtrokantære frakturer bør individuelt afvejes i forhold til mulig effekt af vedvarende behandling.
Der er generelt ikke evidens for behandlingspause med antiresorptive lægemidler. For alendronat kan behandlingspause kan overvejes efter minimum 5 års behandling for zoledronsyre efter 3 år, hvis alle følgende forhold er opfyldte:
- T-score > -2.5 i hofte (kvindelig referenceområde)
- Fravær af lavenergifraktur i columna og hofte
- Fravær af andre lavenergifrakturer i behandlingsperioden
Eventuel behandlingspause afgøres ud fra en individuel vurdering af risikoprofil. Der er ikke klart, hvordan patienter bør observeres efter ophør af behandlingen eller hvornår denne eventuelt vil skulle genoptages. Der foreslås kontrol af BMD 1-2 år efter behandlingsophør.
Bemærk, at i modsætning til bisfosfonatbehandling vil ophør med denosumab behandling resultere i et hurtigt og markant fald i BMD. Der er eksempler på ophobede vertebrale frakturer og hypercalcæmi efter seponering af længerevarende behandling med denosumab. Derfor bør man i udgangspunktet fortsætte behandlingen med demosumab. Ved ønske om behandlingsophør med denosumab børskiftes til et andet (antiresorptivt) lægemiddel. Dette bør opstartes 6-9 måneder efter seneste administration af denosumab. Skift til et andet antiresorptivt lægemiddel kan dog ikke afbøde fald i BMD, men mindske det markant. Det tilrådes derfor at monitorere BMD, ioniseret Ca og evt knoglemarkører.
F. Behandlingssvigt
Generelt opfattes et signifikant faldende BMD (dvs. > 3% i columna eller 4% i total hofte) og/eller 2 eller flere lavenergifrakturer efter mindst 1 års behandling med god komplians som behandlingssvigt.
I tilfælde af behandlingssvigt vurderes patientens komplians, og det overvejes, om der er nyopstået eller overset konkurrerende sygdom. Hvis en korrigerbar årsag til behandlingssvigtet ikke kan identificeres, skiftes behandling efter følgende algoritme:
- Svagere peroral antiresorptiva til stærkere peroral antiresorptiva
- Stærkere peroral antiresorptive til sc eller iv administreret antiresorptiva
- Ved nypopstået vertebral fraktur overvejes anabol behandling
Hypogonadisme
Testosteron øger BMD hos hypogonade mænd, men der er ikke påvist effekt af testosteronbehandling mht frakturforebyggelse.
Bisfosfonater, denosumab og teriparatid øger BMD hos mænd med reduceret niveau af testosteron. Patienter med iatrogen hypogonadisme på grund af anti-androgen behandling kan behandles med bisfosfonat (po. eller iv.) eller denosumab
Der henvises i øvrigt til behandlingsvejledningen for mandlig hypogonadisme.
Der henvises i øvrigt til behandlingsvejledningen for Mandlig testosteronmangel.
Calcium/vitamin D
Der anbefales et dagligt indtag af 20 mikrogram vitamin D og 800-1000 mg calcium (samlet kost og evt. tilskud) hos mænd med osteoporose, uanset om der gives specifik osteoporosemedicin.
Mange fødeemner indeholder kalk. Kalkindtaget kan vurderes ved hjælp af følgende
Calcium (mg/døgn) = 300 + (150 × » antal glas mælk«) + (200 × »antal skiver ost«) + (250 × »portioner mælkemad (grød, surmælksprodukter osv«)
Forud for opstart af antiosteoporotisk behandling måles 25-OH-vitD. Ved 25-OH-vitD < 50 nmol/L og/eller tegn på osteomalaci er antiresorptiv behandling kontraindiceret. Ved tegn på osteomalaci fortsættes behandlingen i et år, hvorefter der re-skannes. I øvrige tilfælde kan antiresorptiv behandling påbegyndes, når 25-OH-vitD er > 50nmol/L.
Referencer
1. Sambrook P, Cooper C. Osteoporosis. Lancet. 2006;367(9527):2010-8.
2. Center JR, Nguyen TV, Schneider D, Sambrook PN, Eisman JA. Mortality after all major types of osteoporotic fracture in men and women: an observational study. Lancet. 1999;353(9156):878-82.
3. Khosla S, Amin S, Orwoll E. Osteoporosis in men. Endocr Rev. 2008;29(4):441-64.
4. Drake MT, Murad MH, Mauck KF, Lane MA, Undavalli C, Elraiyah T, et al. Clinical review. Risk factors for low bone mass-related fractures in men: a systematic review and meta-analysis. J Clin Endocrinol Metab. 2012;97(6):1861-70.
5. Orwoll E, Ettinger M, Weiss S, Miller P, Kendler D, Graham J, et al. Alendronate for the treatment of osteoporosis in men. N Engl J Med. 2000;343(9):604-10.
6. Boonen S, Orwoll ES, Wenderoth D, Stoner KJ, Eusebio R, Delmas PD. Once-weekly risedronate in men with osteoporosis: results of a 2-year, placebo-controlled, double-blind, multicenter study. J Bone Miner Res. 2009;24(4):719-25.
7. Boonen S, Reginster JY, Kaufman JM, Lippuner K, Zanchetta J, Langdahl B, et al. Fracture risk and zoledronic acid therapy in men with osteoporosis. N Engl J Med. 2012;367(18):1714-23.
8. Ringe JD, Dorst A, Faber H, Ibach K. Alendronate treatment of established primary osteoporosis in men: 3-year results of a prospective, comparative, two-arm study. Rheumatol Int. 2004;24(2):110-3.
9. Lyles KW, Colon-Emeric CS, Magaziner JS, Adachi JD, Pieper CF, Mautalen C, et al. Zoledronic acid and clinical fractures and mortality after hip fracture. N Engl J Med. 2007;357(18):1799-809.
10. Orwoll ES, Binkley NC, Lewiecki EM, Gruntmanis U, Fries MA, Dasic G. Efficacy and safety of monthly ibandronate in men with low bone density. Bone. 2010;46(4):970-6.
11. Langdahl BL, Teglbjaerg CS, Ho PR, Chapurlat R, Czerwinski E, Kendler DL, et al. A 24-month Study Evaluating the Efficacy and Safety of Denosumab for the Treatment of Men With Low Bone Mineral Density: Results From the ADAMO Trial. J Clin Endocrinol Metab. 2015:jc20144079.
12. Kaufman JM, Audran M, Bianchi G, Braga V, Diaz-Curiel M, Francis RM, et al. Efficacy and safety of strontium ranelate in the treatment of osteoporosis in men. J Clin Endocrinol Metab. 2013;98(2):592-601.
13. Orwoll ES, Scheele WH, Paul S, Adami S, Syversen U, Diez-Perez A, et al. The effect of teriparatide [human parathyroid hormone (1-34)] therapy on bone density in men with osteoporosis. J Bone Miner Res. 2003;18(1):9-17.
14. Kaufman JM, Orwoll E, Goemaere S, San Martin J, Hossain A, Dalsky GP, et al. Teriparatide effects on vertebral fractures and bone mineral density in men with osteoporosis: treatment and discontinuation of therapy. Osteoporos Int. 2005;16(5):510-6.
15. Smith MR, Egerdie B, Hernandez Toriz N, Feldman R, Tammela TL, Saad F, et al. Denosumab in men receiving androgen-deprivation therapy for prostate cancer. N Engl J Med. 2009;361(8):745-55.
16. Michaelson MD, Kaufman DS, Lee H, McGovern FJ, Kantoff PW, Fallon MA, et al. Randomized controlled trial of annual zoledronic acid to prevent gonadotropin-releasing hormone agonist-induced bone loss in men with prostate cancer. J Clin Oncol. 2007;25(9):1038-42.
Tovholder
Jane Dahl Andersen
seneste revision: 2020
næste revision: 2025
Forfattere og interessekonflikter
Pernille Hermann
Morten Frost
Bo Abrahamsen
Peter Vestergaard
Henrik A Sørensen
Peter Schwarz
Pia Eiken
Interessekonflikter:
Pernille Hermann: Har ikke aktier i, men er tilknyttet advisory boards for firmaer, der producerer og markedsfører lægemidler til behandling af osteoporose (Amgen, UCB, Gedeon Ricter). Peter Schwarz: Bestyrelse LEO Fondet og LEO Holding. Advisory board Abbvie. Foredrag Roche. Aktier Novo Nordisk, Lundbeck, Genmab. Pia Eiken: Advisory board Amgen, Gedeon. Foredrag Amgen, Eli Lilly, AztraZenica. Aktier Novo Nordisk. Peter Vestergaard: Foredrag Amgen, Novartis, MSD, Eli Lilly, kliniske forsøg: Kyowa Kirin, NPS, Leo