Indledning
Kirurgisk behandling af svær overvægt (bariatrisk kirurgi) har til formål at reducere de negative helbredsmæssige konsekvenser af svær overvægt ved at inducere et stort og ofte blivende vægttab. Gastrisk bypass (RYGB) og sleeve gastrektomi (SG) er de hyppigste procedurer. I alt har cirka 25 000 danskere fået foretaget bariatrisk kirurgi i Danmark (2022). Der blev udført cirka 1800 operationer i 2021 (29 % RYGB) Der findes ikke opgørelser over antallet af danskere, der har fået foretaget bariatrisk kirurgi i udlandet.
Hvad omfatter denne NBV
Forløbet omkring og komplikationer til Roux-en-Y gastrisk bypass (RYGB) og Sleeve gastrektomi (SG).
Hvad omfatter denne NBV ikke
Non-kirurgisk vægttabsbehandling (link), plastikkirurgi efter bariatrisk kirurgi, og andre bariatriske kirurgiske procedurer end ovenfornævnt, ej heller eksperimentelle bariatriske kirurgiske procedurer.
Diagnosekoder
Roux-en-Y gastrisk bypass (KJDF10, KJDF11), Sleeve gastrektomi (KJDF40, KJDF41), Tilstand med gastrisk bypass (Z98.0C), Tilstand med gastrisk sleeve resektion (Z98.0D)
Følgetilstand efter bariatrisk kirurgi (DT983B) efterfulgt af:
- Jernmangelanæmi pga. malabsorption af jern (D50.1)
- Anden form for hypoglykæmi (E16.1)
- Osteomalaci efter operation (M83.2A) /D-vitamin mangel uden specifikation(E55.9)
- Svær proteinmangelsygdom uden specifikation (E43.9)
- Mild proteinmangelsygdom uden specifikation (E44.1)
- Moderat proteinmangelsygdom uden specifikation (E44.0)
- Postgastrektomi-syndrom (K91.1)
- Polyneuropati uden specifikation (G62.9)
- Mavesmerter (R10)
Organisation, visitation og henvisning
Hvem kan tilbydes bariatrisk kirurgi?
Kriterierne for at tilbyde bariatrisk kirurgi ændrer sig løbende og de aktuelle (2023) er som beskrevet i Tabel 1.
Tabel 1. Indikationer og kontraindikationer for bariatrisk kirurgi*
| BMI>35 kg/m2 og mindst én af følgende overvægtsrelaterede sygdomme/tilstande. a. Type 2 diabetes b. Svær regulerbar hypertension c. Dokumenteret søvnapnø d. Graviditetsønske og fertilitetsproblemer hos kvinder med polycystisk overiesyndrom (PCOS) e. Symptomgivende artrose i underekstremiteterne, hvor andre behandlingsmuligheder ved aktuel vægt er udtømte |
| Ved BMI < 40 kg/m2 uden de specifikke komplikationer angivet i punkt 1 tilbydes i princippet ikke bariatrisk kirurgi |
| BMI > 40 kg/m2: Bariatrisk kirurgi kan tilbydes efter individuel lægefaglig vurdering, når der foreligger en væsentlig sundhedsfaglig begrundelse (andet end nævnt under punkt 1). Det kan f.eks. være ved behov for større vægttab forud for en anden sundhedsmæssig vigtig behandling fx operation, betydende hjerte-karsygdom, benign intrakraniel hypertension, ved ekstrem invaliderende overvægt (ofte BMI >50 kg/m2) samt ved helt specielle psykiske og sociale forhold (f.eks. svær social isolation, truet erhvervsevne etc.). |
| Alderskrav: Tilbydes til voksne over 18 år. Der bør udvises stor tilbageholdenhed og foreligge en skærpet indikation ved operation af såvel unge (18- 25 år) som ældre (>60 år). |
| Rygestop: Forudsætning for bariatrisk kirurgi er rygestop (inklusiv stop med E-cigaretter) mindst 6 uger før operation for at mindske risikoen for operationskomplikationer |
| Kontraindikation – absolutte og relative: Omfatter i det væsentligste misbrug, spiseforstyrrelser, svær udviklingshæmning, svær psykiatrisk lidelse, visse cancerdiagnoser < 5 år og kirurgiske (f.eks motilitetsforstyrrelse i mavetarmkanalen, levercirrose med portal hypertension, tidligere større intraabdomianle operationer) eller anæstesiologiske kontraindikationer. Specifikt for SG: Hiatushernie eller symptomatisk svær refluks |
*Disse kriterier bygger på en rapport fra Sundhedsstyrelsen (National Klinisk Retningslinje: Fedmekirurgi (NKR) fra 2017 og Visitationsretningslinjerne (VR 2017). Sundhedsstyrelsen har i 2023 udmeldt, at de betragter NKR rapporten fra 2017 som forældet, da den ikke er opdateret siden 2017. Da der i dansk sammenhæng ikke foreligger nogen nyere gennemgang af visitationskriterierne bl.a. med deltagelse af Danske Regioner, der er økonomisk ansvarlig, anvendes de samme kriterier som i 2020 udgaven af DES’ NBV. Der igangsættes en proces med henblik på at få opdateret visitationskriterierne fra DES’ side.
På alle bariatriske centre bør der være tilgang til et multidisciplinært (bariatrisk) team (MDT), bestående af endokrinologer, diætister, sygeplejersker og kirurger – alle med særlig erfaring og ekspertise indenfor bariatrisk kirurgi. MDT kan ved behov suppleres med speciallæger i f.eks. anæstesi, psykiatri eller gynækologi og obstetrik. På regelmæssige MDT møder, diskuteres bl.a. komplekse patienter samt henviste patienter, der ikke opfylder de klassiske kriterier for bariatrisk kirurgi nævnt i Tabel 1.
Henvisning til bariatrisk kirurgi
Henvisning til bariatrisk kirurgi i offentligt regi skal sendes til de(n) afdeling i regionen, som jf. den endokrinologiske specialeplan er udpeget til visitation til bariatrisk kirurgi, sædvanligvis en endokrinologisk afdeling (Sundhedsstyrelsens Specialeplan). Forud for henvisning forudsættes det, at patienten i et længere forløb, inden for de seneste 3 år, har forsøgt superviseret non-kirurgisk vægttabsbehandling gerne suppleret med medicinsk behandling (se NBV Svær overvægt: non-kirurgisk behandling, link). Henvisningen skal udformes som beskrevet i Tabel 2.
Forud for henvisningen bør henvisende læge overordnet have diskuteret de væsentligste fordele og ulemper ved bariatrisk kirurgi med patienten (Tabel 3).
Tabel 2. Krav til udformning af henvisning forud for bariatrisk kirurgi (link)
| Anamnese | Beskrivelse af tidligere forsøg på vægttab, herunder dokumentation for superviseret vægttabsbehandling inklusiv medicinsk behandling inden for de sidste 3 år. Angivelse af vægttabenes størrelse. Dispositioner til svær overvægt Forekomst af overvægtsrelaterede sygdomme, samt aktuel behandling herfor og hvornår og hvordan disse sygdomme er diagnosticeret. Anden komorbiditet, inklusiv tidligere abdominale operationer Aktuel og tidligere psykiatrisk sygdom (inklusiv spiseforstyrrelser og misbrug) Andre relative kontraindikationer (Tabel 1) |
| Objektivt | Vægt, højde og BMI |
Tabel 3: Fordele og ulemper ved bariatrisk kirurgi
| RYGB | SG | Kommentar | |
| Fordele | |||
| Vægttab | ++++ | +++ | 25-40% af kropsvægten (50-80% af overvægten), lidt mindre ved SG >5 år efter operationen |
| Bedring af diabetes regulering / nedsat risiko for at udvikle type 2 diabetes | ++++ | +++ | Fuld remission hos 40- 60% efter RYGB |
| Bedring af andre følgesygdomme (fx hypertension, søvnapnø, PCOS) | +++ | ++ | |
| Ulemper | |||
| Operationskomplikationer (sårinfektion, blødning, tromboemboli, anastomoselækage) | + | + | |
| Risiko for vitamin og mineral mangel | +++ | ++ | Særligt jern-, kalk-, D-vitamin- og B12-mangel |
| Risiko for svær dumping eller reaktiv hypoglykæmi | ++ | (+) | |
| Risiko for gastroøsofagal refluks | + | +++ | |
| Risiko for intern herniering/ileus | + | – | |
| Risiko for kroniske mavesmerter | ++ | + | |
Patientforløb
Præoperativt forløb
For at sikre optimalt resultat skal præoperativ udredning, bariatrisk kirurgi og postoperativ opfølgning ses som et sammenhængende patientforløb. Patientforløbet er identisk for SG og RYGB. Se Figur 1.
Figur 1. Forløb for bariatrisk kirurgi. Patienten kan i hele forløbet henvises til MDT.
Tabel 4: Præ- og postoperativ biokemisk monitorering
| Præoperativt: | Ved årlige kontroller postoperativt (> 2 år postoperativt foregår kontrollerne hos egen læge)*: |
| Hæmoglobin, MCV, MCHC, trombocytter, ferritin, folat, vitamin B12, crp, leukocytter | Hæmoglobin, transferrin-mætning, ferritin, folat, vitamin B12, crp |
| Natrium, kalium, kreatinin, albumin | Natrium, kalium, kreatinin, albumin |
| ALAT, basisk fosfatase | |
| PTH, calcium (total albumin-korrigeret eller ioniseret), magnesium, 25-OH-vitamin D | PTH, calcium (total albumin-korrigeret eller ioniseret), 25-OH-vitamin D, evt. magnesium |
| Total-kolesterol, LDL-kolesterol, HDL-kolesterol | Total-kolesterol, LDL-kolesterol, HDL-kolesterol |
| HbA1c | HbA1c (ved tidligere type 2 diabetes eller på mistanke om diabetes) |
| TSH |
* Ved tegn på mangeltilstande tages supplerende blodprøver.
Ved forundersøgelsen udredes patienten for egnethed til bariatrisk kirurgi. Patienten udredes biokemisk som i Tabel 4. Det sikres, at patienten opfylder kriterierne for bariatrisk kirurgi, samt at der ikke foreligger medicinske, anæstesiologiske, kirurgiske eller psykiatriske kontraindikationer for operationen. Der informeres om fordele og ulemper ved de to kirurgiske metoder samt risici for kirurgiske, medicinske og ernæringsmæssige komplikationer (Tabel 3). Vitamin- og mineralmangel søges korrigeret og behandling af følgesygdomme såsom dysreguleret type 2 diabetes (HbA1c >70 mmol/mol), svær søvnapnø (AHI-index >30) og/eller hypertension søges optimeret.
Patienten informeres om, at der skal dokumenteres et vægttab på minimum 8 % af udgangsvægt sædvanligvis opnået inden for et forløb på 3-6 måneder. Vægttabet skal resultere i en reduktion af leversteatose for at lette operationen. Det præoperative vægttab kan opnås ved hjælp af forskellige former for hypokalorisk diæt eventuelt suppleret med medicinsk behandling.
Når patienten er vurderet egnet til bariatrisk kirurgi
- Kirurgisk forundersøgelse, hvor eventuelle kirurgiske problematikker afklares og operationstypen aftales eller konfirmeres.
- Anæstesiologisk forundersøgelse
- Flere centre tilbyder desuden struktureret patientundervisning, der skal sikre at patienterne har modtaget fyldestgørende information om operationen samt det peri- og postoperative forløb.
- Perioperativ lavmolekylært heparin iht. lokale retningslinjer.
- Anfør peri- og postoperativ plan for diabetesbehandling i journalen. (Link til særlige tilstande Diabetes)
- Undersøgelse for helicobacter pylori infektion kan foretages med urea-breath-test eller ved fæces-antigen-test. Begge har en høj sensitivitet >95%, men sensitiviteten reduceres ved pågående brug af protonpumpehæmmere og antibiotika. Ved positiv test behandles iht. lokale retningslinjer. Afhængig af individuel vurdering, kan patienten re-testes efter behandling.
Perioperativt forløb
Bariatrisk kirurgi udføres altid laparoskopisk og patienten forventes udskrevet dagen efter operation med særlige diætetiske anbefalinger i forhold til kosten de første 4 uger. Man kan forvente at genoptage arbejde efter 2-4 uger afhængig af erhverv. Der er ikke restriktioner ift. tunge løft idet operationen udføres laparoskopisk.
Roux-en-Y Gastrisk Bypass
Ved operationen deles ventriklen i to, en lille ny fungerende ventrikel (pouchen) og resten der lades urørt men er shuntet ud. Til pouchen kobles nu tyndtarmen og 1-1½ m nede kobles til sidst afløbet fra den udshuntede ventrikel og duodenum. Der fjernes intet væv under operationen.
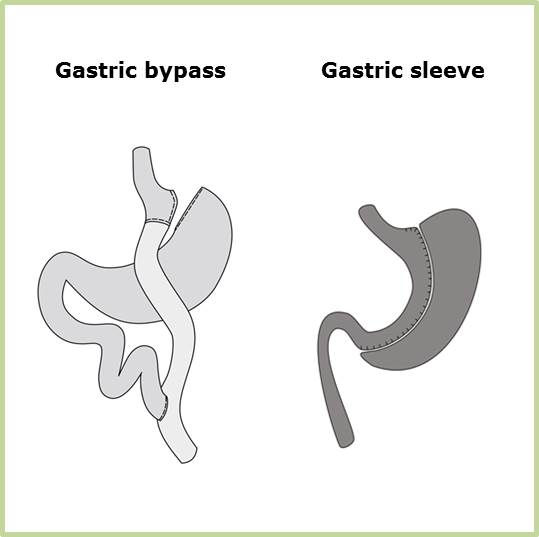
Gastrisk Sleeve
Ved operationen deles ventriklen fra antrum til tæt på øsofagus, således at der skabes et langt indsnævret ventrikelrør. Den overskydende del af ventriklen fjernes under operationen.
Tidlige postoperative komplikationer efter RYGB og SG
Risiko for blødning (1-2 %), infektion (1-2 %), porthulshernier (2-4 %), lækage ved pouch (RYGB)/stablerlinje (SG) (1 %) og død (0.04 %).1,2
Patienter, som har fået foretaget bariatrisk kirurgi skal instrueres i at kontakte det opererende center direkte ved feber, mavesmerter, gentagne opkastninger eller utilpashed de første 30 dage efter operationen.
Postoperativt forløb
Patienten følges ambulant af diætist, sygeplejerske og eventuelt læge i medicinsk regi af den visiterende medicinske afdeling i to år efter operationen med henblik på til at evaluere og justere den medicinske behandling af følgesygdomme, samt tidligt at påvise mangeltilstande eller andre komplikationer. Se Tabel 4 og afsnittet om biokemisk monitorering efter bariatrisk kirurgi.
Ved ukompliceret forløb, afsluttes patienten efter 2 år i hospitalsregi til årlige kontroller ved egen læge (se Tabel 4). Ved den afsluttende 2-års kontrol i hospitalsregi spørges der også til ønske om plastikkirurgisk vurdering i henhold til gældende retningslinjer (https://www.sst.dk/da/udgivelser/udgivelser-opdelt-i-emner/visitation/~/media/805344BC849E4050857B85345AC14F39.ashx). Patienten kan genhenvises ved recidiv af type 2 diabetes eller betydende medicinsk komplikation (svær vitamin/mineral mangel herunder jernmangelanæmi, som ikke kan korrigeres ved justering af peroralt tilskud, mistanke om reaktiv hypoglykæmi, osteoporose) og ved mistanke om kirurgisk komplikation (ulcus, stenose, kroniske mavesmerter).
Patienter opereret med bariatrisk kirurgi i udlandet tilbydes som udgangspunkt ikke rutinemæssig endokrinologisk hospitalsopfølgning ved et dansk bariatrisk center, men kan henvises ved komplikationer under samme kriterier som patienter opereret i Danmark.
Diætetiske anbefalinger
Post-operativt
De diætetiske anbefalinger for RYGB og SG er enslydende og skal sikre sufficient proteintilførsel, en glidende overgang til normalkost og minimere risikoen for kostrelaterede komplikationer som dumping og hyperinsulinæmisk hypoglykæmi. Patienterne anbefales som udgangspunkt at indtage små mængder mad og drikke ad gangen, at adskille mad og drikke, at spise langsomt og tygge maden grundigt og minimere indtag af sukker og fedtrige levnedsmidler.3 De første 1-2 måneder efter operationen anbefales patienten en langsom optrapning fra flydende til normal kost. Denne periode kan variere fra patient til patient og mellem hospitaler.
Kostrelaterede problemer:
Når kostens konsistens bliver mere fast, er der levnedsmidler, der kan volde problemer. Her ses store individuelle forskelle. Oftest skyldes disse problemer en uhensigtsmæssig spiseteknik, f.eks. at patienten spiser for hurtigt, spiser for store mængder ad gangen, drikker til maden eller tygger føden utilstrækkeligt. Mange af disse problemer kan afhjælpes med diætetisk vejledning. Nogle patienter oplever i perioden med flydende kost diarré, ved vedvarende symptomer kan dette skyldes en udiagnosticeret laktoseintolerence og udredning kan overvejes.
Vitamin og mineraltilskud efter bariatrisk kirurgi (gælder RYGB og SG)
Tilskud
På trods af forskelle mellem RYGB og SG også med hensyn til absorption af vitaminer og mineraler, anbefales som udgangspunkt samme mineral- og vitamintilskud livslangt postoperativt (Tabel 5). Kosttilskud anbefales justeret i henhold til den tilbagevendende biokemiske kontrol. I praksis vil det ofte hos mænd og postmenopausale kvinder kunne komme på tale at reducere eller helt fjerne jerntilskud og efter SG evt. også B12-tilskud. For de fleste patienter startes vitamin- og mineraltilskud efter 4-6 uger, dog kan tilskudsbehandling startes tidligere.
Tabel 5. Praktiske anbefalinger for vitamin og mineral tilskud efter bariatrisk kirurgi4
| Vitamin/mineral | Anbefalet tilskud | Behandling af mangeltilstand |
| Kalk og D-vitamin | 800 mg calcium 75µg (3000IU) D-vitamin Deles på mindst 2 doser
| Juster indtag af calcium og D-vitamin til PTH, ion-calcium, D-vitamin og basisk fosfatase i normalområdet.
I svære behandlingsrefraktære tilfælde kan cholecalciferol (p.o. Benferol® eller i.m Vicotrat®) forsøges.
|
| Jern | 100mg Fe2+ hvilket følgende præparater indeholder:
200 mg ferrosulfat (1 stk Ferro Duretter®)
310 mg ferrofumurat (1 stk Jern C®)
Hos menstruerende kvinder anbefales dobbelt dosis | Jern skal tages adskilt fra kalk tilskud eller syrepumpehæmmere.
Ved jernmangelanæmi trods relevant behandling med p.o. jern, ved intolerance for p.o. jern eller ved udtalte kliniske symptomer gives i.v. jern (Venofer® eller Monofer®). Træthed og lavt ferritin niveau med normal Hb ikke i sig selv indicerer iv jern-behandling. |
| Vitamin B12 | 500 µg – 1mg
Fx Tbl. Betolvex® x 1 dgl. eller Vibeden® injektion | F.eks. intramuskulær injektion af hydroxocobalamin 1 mg. hver anden dag til i alt 5 gange, herefter livslangt hver 3. måned.
|
| Andre; Vitamin B1 (thiamin), A, K, Magnesium, Zink, Kobber, Folinsyre. | Thiamin 1,2 mg Vitamin A: 5000-10000IU Vitamin K: 90- µg mcg Magnesium: 400mg Zink: 15-22mg Kobber: 1-2mg Folinsyre:400-1000 µg
Ovenstående doser kan opnås ved fx: 2 stk. Multivitamin 50+
| Thiamin: Ved mistanke om Wernickes encephalopati behandles på mistanken alene. Se behandling jf. NBV Anorexia nervosa
Vitamin A: Med cornea forandringer: 50.000-100.000 IU vitamin A I.M i 3 dage efterfulgt af 50.000IU IM dgl i 2 uger Uden cornea forandringer: 10.000-25.000 p.o. dgl indtil svind af symptomer
Magnesium: jf. NBV hypomagnesiæmi |
Biokemisk monitorering efter bariatrisk kirurgi
Der henvises til Tabel 4. Hvis mangeltilstande påvises forsøges dette korrigeret ved at sikre compliance og eventuelt supplere med yderligere tilskud jf. Tabel 5 og anden relevant behandling (se særlige tilstand efter bariatrisk kirurgi). Hvis behandlingsrespons udebliver henvises til relevant ambulatorium (sædvanligvis Endokrinologisk afdeling på lokalsygehus).
Ændret virkning af lægemidler efter bariatrisk kirurgi (især RYGB)
Bariatrisk kirurgi kan i teorien ændre effekten af lægemidler grundet ændrede pH forhold, ændret absorption fra mavetarm-kanalen, ændret first-pass metabolisme (CYP-systemet i tarm og lever) samt ændret fordelingsvolumen som følge af vægttab.5 Specifik viden om de enkelte lægemidler er sparsom. For hovedparten af de undersøgte lægemidler ses en hurtigere absorption og højere peak-værdier, mens biotilgængeligheden (AUC) ofte er uændret. I praksis anbefales øget opmærksomhed på lægemidlers kliniske effekt samt forekomst af bivirkninger efter bariatrisk kirurgi. For at foretage nødvendig dosisjustering anbefales monitorering af plasmakoncentrationer (eksempelvis antiepileptika, antipsykotika) eller biokemisk monitorering (eksempelvis TSH ved behandling af stofskiftesygdomme)
Behandling med NSAID frarådes efter bariatrisk kirurgi grundet en øget risiko for gastrointestinalt ulcus.
Særlige tilstande
Diabetes
Man skal være særlig opmærksom på den glykæmiske regulation hos patienter med diabetes før, under og efter bariatrisk kirurgi.6-9
Præoperativt
Den glykæmiske kontrol bør optimeres forud for bariatrisk kirurgi. Som ved al anden kirurgi hos patienter med diabetes, er dårlig glykæmisk regulation associeret med øget kirurgisk morbiditet. Specielt ved bariatrisk kirurgi tyder studier på bedre vægttabsresultat ved god præoperativ diabeteskontrol. Optimalt bør HbA1c være < 48 mmol/mol, men det vil ofte være svært opnåeligt hos patienter med dårlig regulation og langvarig diabetes. Som ved anden elektiv kirurgi anbefales et HbA1c < 70 mmol/mol præoperativt (link NBV kirurgi og diabetes).
Perioperativt
Type 1 diabetes eller type 2 diabetes med svært nedsat insulin-egenproduktion.
Praktiske erfaringer med bariatrisk kirurgi i patienter med type 1 diabetes har vist, at den glykæmiske variabilitet stiger betydeligt postoperativt, formentlig fordi hastigheden hvormed kulhydrater nedbrydes og absorberes er øget og på grund af manglende egenproduktion af insulin. Virkningen af subkutant administreret insulin er ofte for langsom til at imødekomme den hurtige postprandielle stigning i blodsukker, og der er derfor en betydeligt øget risiko for hyper- og hypoglykæmi. Dette medfører, at man generelt bør være meget tilbageholdende med at tilbyde bariatrisk kirurgi til patienter med type 1 diabetes.10
Det foreslås at ved langvarig insulin-behandlet type 2 diabetes, at der måles C-peptid mhp. at vurdere insulinbehovet efter indgrebet samt med de sammen overvejelser som ved type 1 diabetes i den præoperative situation.
Type 2 diabetes.
Behandling med metformin, sulfonylurea, DPP-4-inhibitorer, SGLT-2-inhibitorer og GLP-1 analoger pauseres umiddelbart forud for bariatrisk kirurgi. Patienter med type 2 diabetes, som behandles præoperativt med insulin skal behandles og monitoreres som ved anden kirurgi (http://endocrinology.dk/index.php/1-diabetes-mellitus/nbv-endokrinologi-diabetes-og-kirurgi-peroral-behandling-insulin-behandling-subkutant-regime-intravenost-regime-gik-drop).
På operationsdagen og de efterfølgende dage (hvor udfordringen er at undgå hypoglykæmi)
Type 2 diabetes.
Efter bariatrisk kirurgi, og specielt efter RYGB operation, vil patienter med diabetes ofte opleve dramatiske effekter på blodsukkeret umiddelbart efter operationen. Der anbefales derfor følgende forholdsregler:
- Insulindosis halveres. Hvis patienten får basal/bolus behandling skal der reduceres markant i mængden af bolus insulin, ofte skal denne seponeres (dog ikke ved type 1 diabetes). Alternativt kan man hos patienter med type 2 diabetes under indlæggelsen i første postoperative døgn estimere behov ud fra insulin efter skema. Hvis behovet er <20 I.E. / døgn seponeres insulin. Hvis behovet er >20 I.E./døgn behandles med langtidsvirkende insulin sv.t. det beregnede behov.
- Metformin giver ikke hypoglykæmi og kan ofte genoptages umiddelbart postoperativt. Dog skal nyrefunktionen kontrolleres før opstart, hvis patienten forud for operation har eGFR< 60 mL/min/1.73 m2 eller kendt nefropati. Metformin kan seponeres ved normalisering af HbA1c.
- Sulfonylurea kan give hypoglykæmi og seponeres, men kan genoptages ved behov.
- SGLT-2-inhibitorer behandling giver ikke hypoglykæmi og kan genoptages ved behov. Det kan være relevant at fortsætte SGLT-2-inhibitorer hos patienter med kendt iskæmisk hjertesygdom (uafhængigt af evt. hjertesvigt eller nyresygdom) da behandling med SGLT-2-inhibitorer hos ptt . med type 2 diabetes i nuværende guidelines er uafhængig af HbA1c. Link til NBV type 2
- Til trods for at det postprandielle endogene GLP-1 (inkretin) niveau er forhøjet efter RYGB, synes inkretin baseret behandling (DPP-4-inhibitorer og GLP-1-analoger) sikker og virksom og kan genoptages ved behov.11
Ændringer i den antidiabetiske behandling kan mest hensigtsmæssigt anføres i journalen forud for det operative indgreb. Det er vigtigt, at patienten monitorerer glukose hyppigt i de første uger postoperativt og i samarbejde med den visiterende afdeling tilpasser behandlingen.
Screening for diabetesrelaterede komplikationer efter operation
Det anbefales at patienter med præoperativ diabetes følger vanlige retningslinjer for screening af diabetiske senkomplikationer resten af livet. 12Link til NBV type 1 og NBV type 2
Fertilitet, prævention og graviditet
Fertilitet og prævention
Kvindelig fertilitet bedres betydeligt allerede under det præoperative vægttab.13 Graviditet frarådes de første 12 måneder postoperativt, da kvindens krop her er i katabol fase, men er ikke indikation for provokeret abort (se i øvrigt vejledning fra Dansk Selskab for Obstetrik og Gynækologi.
Der er forsat uenighed om effekten af oral prævention efter bariatrisk kirurgi, hvorfor hormonspiral, implantat (hormonal kontraceptiv, P-stav) eller omhyggeligt eksekveret barrieremetode anbefales.14,15
Hos kvinder med graviditetsønske, bør man sikre sig, at kvinden er bekendt med anbefalinger vedrørende kosttilskud efter bariatrisk kirurgi (der gælder de samme anbefalinger som for alle andre, se Tabel 5). Eventuelle vitamin- og mineralmangler bør udredes (blodprøver) og korrigeres (Tabel 4).
Kvinder med kendt type 2 diabetes bør henvises og behandles på lige fod med andre patienter med præeksisterende diabetes forud for graviditet (se NBV Præeksisterende diabetes og graviditet) selv hvis HbA1c efter kirurgi for svær overvægt er normal uden anden behandling.
Kontroller i graviditeten
Alle gravide, der er bariatrisk opererede skal tilbydes tværfaglig kontrol ved obstetriker, endokrinolog og diætist (Sundhedsstyrelsens Specialeplan). Kontrolforløbet og mulige komplikationer er beskrevet i NBV fra Dansk Selskab for Obstetrik og Gynækologi (link). Der skal desuden være beskrevet et samarbejde mellem ovennævnte faggrupper og kirurger med erfaring og ekspertise i bariatrisk kirurgi.
Vedrørende diagnostik og eventuel behandling for gestationel diabetes henvises til særskilt afsnit herom i NBV Gestationel diabetes mellitus – Screening og diagnose.
Komplikationer
Medicinske
Hypoglykæmi og dumping
Efter bariatrisk kirurgi specielt efter RYGB kan opstå symptomer, der beskrives som tidlig og sen dumping, hvilket udsiger noget om tidspunktet for symptomerne set i forhold til et måltid. Tidlig dumping eller blot dumping forekommer ofte i slutningen af måltidet eller inden for den første halve time efter måltidet og har en tendens til at aftage med tiden efter operationen (Tabel 6). Sen dumping eller postprandriel hyperinsulinæmisk hypoglykæmi/post-bariatrisk hypoglykæmi (PBH) skyldes reaktiv hypoglykæmi og ses ofte først timer efter måltidet og opstår sædvanligvis efter halve til hele år efter operationen (ofte mange år efter).
Tabel 6. Dumping og hypoglykæmi.
| Dumping symptomer | |
| Tidlig dumping: ( symptomer opstår 10 – 30 min efter måltidet) | Gastrointestinale symptomer: mavesmerter, meteorisme, kvalme, diarre Vasomotoriske symptomer: flushing, palpitationer, svedtendens, hypotension, svimmelhed |
| Sen dumping (hypoglykæmi): (symptomer opstår 1-3 timer efter måltidet) | Hypoglykæmiske symptomer: sved, sult, palpitationer, svaghedsfølelse, synkope |
Behandlingen af dumping er helt overvejende diætetisk og fokuserer på reduktion af kulhydratindtag samt en prioritering af de komplekse kulhydrater. Ligeledes har madens konsistens betydning for det postprandielle respons, hvorfor både spiseteknik (adskille mad og drikke) har betydning, men også at patienten vælger mere fast mad frem for flydende. Dog kan i de sværeste tilfælde overvejes medicinering som ved reaktiv hypoglykæmi (se nedenfor).
Sen dumping i form af hypoglykæmiske symptomer varierer meget i sværhedsgrad fra almindeligt ubehag, koldsved og hjertebanken (5-30% af RYGB patienter) til neurologiske symptomer på svær hypoglykæmi med besvimelse og kramper (<1%). Reaktiv hypoglykæmi forekommer mindre hyppigt efter SG.
Hos patienter som har gennemgået bariatrisk kirurgi bør man derfor have skærpet opmærksomhed på hypoglykæmiske symptomer både ved ambulant opfølgning og i forbindelse med indlæggelse. Den akutte behandling af hypoglykæmi adskiller sig ikke fra gængse retningslinjer for behandling af hypoglykæmi.
Primærbehandlingen af PBH er diætetisk, idet en diæt med reduceret indhold af kulhydrater ofte vil kunne reducere de glykæmiske udsving og insulinproduktionen og dermed frekvensen af hypoglykæmi (se bilag). Ved recidiverende svær/alvorlig hypoglykæmi (hvor andre årsager er udelukket) bør patienten henvises til udredning og behandling i endokrinologisk regi (Aarhus Universitetshospital og Hvidovre Hospital). Udredningen fokuserer på dokumentation af hypoglykæmi, typisk med kontinuerlig glukose monitorering (link til CGM/FGM NBV) i kombination med måltids- og symptomdagbog. Behandlingen fokuserer primært på diætetisk rådgivning. Er dette utilstrækkeligt kan farmakologisk behandling med f.eks. en alfaglukosidase inhibitor (Acarbose) eller somatostatinanalog (Octreotid/Sandostatin LAR) komme på tale. I svære tilfælde kan det været nødvendigt med tilbagelægning af RYGB’en (se bilag 1 i slutningen af denne NBV for detaljeret beskrivelse af udredning og behandling af PBH).
Anæmi:
Anæmi er en hyppig komplikation efter både RYGB og SG, særligt hos kvinder i den fertile alder og skyldes oftest jernmangel som følge af nedsat intestinal jernabsorption, alternativt B12-vitaminmangel eller andre sjældnere vitamin/mineral mangeltilstande. Udredning følger vanlige retningslinjer for anæmi-udredning herunder udelukkelse af blødningskilde (vær opmærksom på forøget risiko for ulcus efter både RYGB og SG). Særligt gastroskopi kan kræve specialisterfaring. Ved simpel jernmangelanæmi anbefales peroralt jerntilskud 200 mg dagligt, dosis kan fordobles ved utilstrækkelig effekt såfremt dette tolereres. Hos kvinder uden graviditetsønske kan blodtab i forbindelse med menstruationer reduceres med hormonspiral. Hvis peroral behandling ikke kan gennemføres kan intravenøs jernsubstitution komme på tale (Tabel 5).
Diarre:
Kronisk diarre efter bariatrisk kirurgi ses oftere efter RYGB end efter SG. Diarre kan optræde i relation til dumping, som ofte kan afhjælpes med diætbehandling. Diarre kan også optræde som konsekvens af bakteriel overvækst eller på grund af eksokrin pancreasinsufficiens; men andre årsager kan forekomme (bivirkning til medicin, galdesyremalabsorption, patogene tarmbakterier etc), og der kan være behov for vurdering ved medicinsk gastroenterolog. Særligt kan bakteriel overvækst være vanskelig at diagnosticere, da breath test metoderne ikke er valideret i patienter med accelereret gastrointestinal passagetid (høj rate af falsk positive).
Malabsorption af vitaminer og mineraler (særligt kalk og D-vitamin):
Særligt efter RYGB er absorptionen af fedtopløselige vitaminer og nogle mineraler kompromitteret. Derudover ses et tab i knoglemineralindhold grundet stort vægttab (nedsat belastning af knoglerne). Utilstrækkelig tilførsel af kalk og D-vitamin kan medføre sekundær hyperparathyroidisme, der kan bidrage til yderligere afkalkning af knogler. Derfor anbefales substitution med kalk og D-vitamin (Tabel 5). Screening for osteoporose med DXA (dual X-ray absorptiometry) anbefales til postmenopausale kvinder eller ved lavenergifrakturer.
Kirurgiske:
Postoperative kirurgiske komplikationer < 1 måned efter operationen:
Patienten bør ses af det opererende bariatriske team ved feber, smerter og/eller opkastning. Anastomoselæk fra staplerlinjerne, intraabdominale abscesser, mesenteriel trombose og/eller ulcus/stenose kræver hurtig håndtering af komplikationen. Patienter med betydende synkebesvær, kan blive så dehydrerede, at en indlæggelse til iv væske vil være hensigtsmæssig.
Postoperative kirurgiske komplikationer > 1 måned efter bariatrisk kirurgi og < 2 år:
Efter RYGB er intern herniering, galdesten og ulcus de hyppigste komplikationer på lang sigt. Invagination, volvulus, porthulshernier, hiatushernie og sammenvoksninger ses. Efter SG vil op til 30% få refluks, mens nogle få vil slippe af med deres refluks pga. vægttabet. Stenose, hiatushernie, porthulsbrok og ulcus ses også ved SG. Patienten henvises primært til lokal kirurgisk afdeling, hvor der afhængigt af symptomer udredes med relevant billeddiagnostik og gastroskopi. Ved inkonklusiv udredning henvises til kirurgisk bariatrisk vurdering med henblik på diagnostisk laparoskopi og mere specialiserede undersøgelser.
Postoperative kirurgiske komplikationer > 2 år efter operationen:
Som ovenfor, men grundig medicinsk gennemgang er obligatorisk. Efter udredning på kirurgisk og medicinsk specialafsnit for bariatri har en mindre gruppe på omkring 5-10% fortsat kroniske mavesmerter og disse patienter vil ofte blive henvist til smerteklinikker. Disse patienter diskuteres på regional MDT konference.
Referencer
- Gribsholt SB, Thomsen RW, Svensson E, Richelsen B. Overall and cause-specific mortality after Roux-en-Y gastric bypass surgery: A nationwide cohort study. Surg Obes Relat Dis 2017; 13(4): 581-7.
- Poelemeijer YQM, Liem RSL, Våge V, et al. Gastric Bypass Versus Sleeve Gastrectomy: Patient Selection and Short-term Outcome of 47,101 Primary Operations from the Swedish, Norwegian, and Dutch National Quality Registries. Ann Surg 2019: 10.1097/SLA.0000000000003279.
- Stano S, Alam F, Wu L, et al. Effect of meal size and texture on gastric pouch emptying and glucagon-like peptide 1 after gastric bypass surgery. Surg Obes Relat Dis 2017; 13(12): 1975-83.
- Mechanick JI, Apovian C, Brethauer S, et al. CLINICAL PRACTICE GUIDELINES FOR THE PERIOPERATIVE NUTRITION, METABOLIC, AND NONSURGICAL SUPPORT OF PATIENTS UNDERGOING BARIATRIC PROCEDURES – 2019 UPDATE: COSPONSORED BY AMERICAN ASSOCIATION OF CLINICAL ENDOCRINOLOGISTS/AMERICAN COLLEGE OF ENDOCRINOLOGY, THE OBESITY SOCIETY, AMERICAN SOCIETY FOR METABOLIC & BARIATRIC SURGERY, OBESITY MEDICINE ASSOCIATION, AND AMERICAN SOCIETY OF ANESTHESIOLOGISTS – EXECUTIVE SUMMARY. Endocr Pract 2019; 25(12): 1346-59.
- Angeles PC, Robertsen I, Seeberg LT, et al. The influence of bariatric surgery on oral drug bioavailability in patients with obesity: A systematic review. Obes Rev 2019; 20(9): 1299-311.
- McTigue KM, Wellman R, Nauman E, et al. Comparing the 5-Year Diabetes Outcomes of Sleeve Gastrectomy and Gastric Bypass: The National Patient-Centered Clinical Research Network (PCORNet) Bariatric Study. JAMA Surg 2020: e200087.
- Bland CM, Quidley AM, Love BL, Yeager C, McMichael B, Bookstaver PB. Long-term pharmacotherapy considerations in the bariatric surgery patient. Am J Health Syst Pharm 2016; 73(16): 1230-42.
- Perna M, Romagnuolo J, Morgan K, Byrne TK, Baker M. Preoperative hemoglobin A1c and postoperative glucose control in outcomes after gastric bypass for obesity. Surg Obes Relat Dis 2012; 8(6): 685-90.
- Thorell A, Hagström-Toft E. Treatment of diabetes prior to and after bariatric surgery. J Diabetes Sci Technol 2012; 6(5): 1226-32.
- Parmar C, Appel S, Lee L, Ribeiro R, Sakran N, Pouwels S. Choice of Bariatric Surgery in Patients with Obesity and Type 1 Diabetes Mellitus? an Up-to-Date Systematic Review. Obes Surg 2022; 32(12): 3992-4006.
- Miras AD, Pérez-Pevida B, Aldhwayan M, et al. Adjunctive liraglutide treatment in patients with persistent or recurrent type 2 diabetes after metabolic surgery (GRAVITAS): a randomised, double-blind, placebo-controlled trial. The lancet Diabetes & endocrinology 2019; 7(7): 549-59.
- Madsen LR, Baggesen LM, Richelsen B, Thomsen RW. Effect of Roux-en-Y gastric bypass surgery on diabetes remission and complications in individuals with type 2 diabetes: a Danish population-based matched cohort study. Diabetologia 2019; 62(4): 611-20.
- Milone M, De Placido G, Musella M, et al. Incidence of Successful Pregnancy After Weight Loss Interventions in Infertile Women: a Systematic Review and Meta-Analysis of the Literature. Obes Surg 2016; 26(2): 443-51.
- Mechanick JI, Youdim A, Jones DB, et al. Clinical practice guidelines for the perioperative nutritional, metabolic, and nonsurgical support of the bariatric surgery patient–2013 update: cosponsored by American Association of Clinical Endocrinologists, the Obesity Society, and American Society for Metabolic & Bariatric Surgery. Endocr Pract 2013; 19(2): 337-72.
- Moreira de Brito C, de Melo ME, Mancini MC, Santo MA, Cercato C. Pharmacokinetics of oral levonorgestrel and ethinylestradiol in women after Roux-en-Y gastric bypass surgery. Surg Obes Relat Dis 2021; 17(4): 673-81.
- Stentebjerg LL, Madsen LR, Støving RK, et al. Hypoglycemia in Pregnancies Following Gastric Bypass-a Systematic Review and Meta-analysis. Obes Surg 2022; 32(6): 2047-55.
- Stentebjerg LL, Madsen LR, Støving RK, et al. Roux-en-Y Gastric Bypass Increases Glycemic Excursions During Pregnancy and Postpartum: A Prospective Cohort Study. Diabetes Care 2023; 46(3): 502-10.
Tovholder
Sigrid Bjerge Gribsholt
Seneste revision: oktober 2023
Næste revision: oktober 2026
Øvrige forfattere
Caroline Bruun Abild (diætist)
Jens Meldgaard Bruun
Kirstine Nyvold Bojsen-Møller
Carsten Dirksen
Anne Samsø Engberg (kirurg)
Lene Ring Madsen
Peter Rask (kirurg)
Bjørn Richelsen
Charlotte Røn Stolberg
René Klinkby Støving
Appendix
Udredning og behandling af svær hypoglykæmi efter bariatrisk kirurgi (post-bariatrisk hypoglykæmi – PBH).
Definition
- PBH er defineret ved hypoglykæmi som sædvanligvis forekommer 1-3 timer efter et måltid, hos personer som tidligere har gennemgået en bariatrisk operation.
Synonymer
- Reaktiv hypoglykæmi efter bariatrisk kirurgi
- Postprandiel hyperinsulinæmisk hypoglykæmi efter bariatrisk kirurgi
- Late dumping syndrom efter bariatrisk kirurgi
Diagnoseregistrering
“Følgetilstand efter fedmekirurgi” (DT983B) efterfulgt af “Anden form for hypoglykæmi” (DE16.1)
Udredning og diagnose:
Anamnese:
En grundig anamnese er vigtig, med beskrivelse af provokerende faktorer, symptomer, tidsmæssigt i forhold til fødeindtag (symptomerne opstår sædvanligvis 1 – 3 timer efter et måltid, men kan også opstå senere), forekomst af natlig hypoglykæmi. Hjælper det at spise og er der foretaget måling af blodsukkerniveau?
Symptomerne opstår oftest fra 6 mdr til flere år efter det bariatriske indgreb. Hvis symptomer viser sig tidligere, drejer det sig formentligt om dumping.
Mistanke om PBH opstår, når en patient har:
- Typiske symptomer på hypoglykæmi
- og der samtidigt måles en lavt blodglukose (sædvanligvis < 3 mM, men disse grænser kan være individuelt forskellige men skal være under 3.9 mM.
- Symptomerne forsvinder efter pt har indtaget mad/kulhydrater/glukose
( Whipples triade).
Tabel 1. Definition på sværhedsgraden af hypoglykæmi
| Sværhedsgrad | Glykæmisk ”cut-of” level for hypoglykæmi |
| Grad 1 hypoglykæmi | Cirkulerende glukose mellem 3.0-3.9 mmol/l |
| Grad 2 hypoglykæmi | Cirkulerende glukose under 3.0 mmol/l |
| Grad 3 hypoglykæmi | Svært tilfælde med ændret mental og/eller fysisk status der kræver assistance til behandling af hypoglykæmien |
Diabetes Care 2017;40:1622-1630 + ADA 2020
Risikofaktorer
Det er ikke muligt at udpege patienter i særlig risiko, men studier tyder på en øget risiko ved 1) kvindeligt køn, 2) episoder med hypoglykæmi før den bariatrisk operation, 3) store vægttab efter operationen, og med en nedsat risiko hos dem der havde Type 2 diabetes før operationen.
Undersøgelser: (undersøgelsesprogrammet kan modificeres afhængigt af lokale forhold)
Blodprøver: fastende blodglukose, insulin og c-peptid
- Når mistanken er rejst udleveres i første omgang et blodsukker-apparat, hvor patienten instrueres i at måle blodglukose ved symptomer. Man kan på den måde ofte adskille egentlig hypoglykæmi fra tidlig dumping. Hvis patientens symptomer ikke er associeret med lavt BS, er der ikke grund til yderligere udredning ift hypoglykæmi (men måske for andre tilstande)
- Continuous glucose monitoring – CGM : Patienter med påvist eller mistænkt hypoglykæmi (ud fra punkt 1) undersøges med mindst 6 døgns CGM (blindet målinger). Et forslag kan være at de første 3 dage indtager patienten sin vanlige kost, efterfulgt af 3 dage på en kulhydratfattig diæt, som tilrettelægges af diætist (pt fører dagbog undervejs – symptomer, kosten, motion etc).
- Måltidstest: Hvis fortsat usikkerhed om diagnosen kan herefter udføres en egentlig måltidstest: Evt. med fortsat CGM påmonteret indtages om morgenen et standardiseret flydende måltid, for at provokere evt. hypoglykæmi. Der udleveres 1 flaske Fresubin Energy Drink som skal indtages i løbet af 15 minutter ( f. eks. Fresenius, Bad Homburg, Germany; 200 mL; 300 kcal; 50% kulhydrater, 15% protein, and 35% fedt). Pt registrerer symptomer i forløbet efter testen og glukose monitoreres resten af dagen via CGM (op til 5 timer efter måltidet). Denne måltidstest skal udføres under observation (laboratorium, ambulatorium, indlæggelse mv.), da der kan være risiko for at der kan opstå svær hypoglykæmi.
- Ved måling af glukose < 3.9 mM sammen med symptomer, har pt PBH (se tabel 1).
Hvis der ikke er en sammenhæng mellem fødeindtag og symptomatiske hypoglykæmiske episoder , f.eks hvis der er natlige episoder med egentlige hypoglykæmi, skal der undersøges for anden årsag til hypoglykæmi:
72 timers total faste (udredning for insulinom): Patienter med atypisk evt natlig hypoglykæmi skal indlægges til 72 timers faste (forudgået af ACTH test).
Behandling:
- Diætetisk (der kan være lokale forskelle i den diætetiske tilgang)
Den primære behandling af post-bariatrisk hypoglykæmi vil altid være diætetisk. Omdrejningspunktet i den diætetiske behandling er en reduktion af indtaget af kulhydrater mhp. at nedbringe den postprandielle glukose stigning og dermed insulin-spikes (der er årsag til den senere hypoglykæmi). En mindre vægtøgning, og dermed reduktion i insulinfølsomheden vil ligeledes ofte have en gavnlig effekt.
Overordnede diætetiske anbefalinger:
- Begræns kulhydratindtaget.
Med udgangspunkt i lav-kulhydrat diætplanen fra CGM perioden vejledes pt. i kulhydrater, typer og påvirkning på blodsukkeret, samt evt kulhydrattælling f.eks. via Diabetesforeningens “Kulhydrattællings-App”. Pt. individuelle tolerancetærskel søges mhp. at opnår bedst mulige compliance. Almindeligvis anbefales et dagligt kulhydratindtag på 75-100 g fordelt på f.eks. 6 måltider – eks. 10-15 g per mellemmåltid og 15-30 g per hovedmåltid. - Vælg komplekse kulhydrater.
Patienten vejledes i at vælge kulhydrater med lavt glykæmisk index. - Små hyppige måltider.
Patienten anbefales at spise små måltider hver 2- 3 time - Med henblik på at fastholde energibalancen lægges der vægt på proteinindtaget(minimum 0.9 g protein/kg) . Primære proteinkilder med høj biologisk værdig tilrådes, såsom kød, fisk, fjerkræ, æg, ost, tørrede bønner og linser
- Fedtindtaget
Sædvanligvis anbefales patienten at øge fedtindholdet i kosten for at opretholde energibalancen (på baggrund af de reducerede kulhydratmængder). Primært umættet fedt i form af nødder, mandler, avocado, fede fisk - Spise- og drikketeknik.
Idet reaktiv hypoglykæmi er en del af dumping syndromet tilrådes pt. at adskille mad og drikke med henblik på at reducere den hurtige passage som sådan samt den hurtige tilførsel af næringsstoffer til tyndtarmen.
Derudover anbefales patienten at spise langsomt og tygge maden grundigt. Gerne 20-30 minutter per måltid.
- Patienten anbefales drikkevarer uden kulhydrater, såsom vand, kaffe, te og kunstigt sødet sodavand/saft.
Alkohol frarådes/begrænses, da dette øger risikoen for hypoglykæmi.
- Medicinsk
Supplerende medicinsk behandling kommer på tale, når patienterne fortsat har både biokemisk hypoglykæmi (se tabel 1) og betydelige subjektive symptomer oftest daglige på trods af længere tids opfølgning hos diætist (en til flere måneder) samt vurdering af god kompliance til kosten. Medicin skal ses som et supplement til diæten.
- Acarbose (alfa-amylasehæmmer) er altid førstevalg. Der gives 25 mg før hvert af de 3 hovedmåltider i tre dage, og hvis det tåles godt øges til 50 mg x 3 dagligt. Max dosis er 100 mg x 3 dagligt; men langt de fleste bliver på 50 mg x 3.
Acarbose er aktuelt ikke markedsført på det danske marked, så midlet kan kun benyttes på afdelinger, som har en generel udleveringstilladelse fra Lægemiddelstyrelsen. Udleveringstilladelsen gælder specifikt ordination af 50 mg per tablet.
Bedring af symptomer + evt bivirkninger følges i løbet af de første uger. Lægekontrol ca. 6-8 uger efter start af behandlingen. Ingen specifikke blodprøver ud over kontrol af HgbA1c.
Alm. bivirkninger: Luft i maven, diarré, mavesmerter
Udlevering: Patienten betaler selv for Acarbose, og der kan søges enkelttilskud, og ofte fås tilskud til behandlingen.
- Somatostatin-analoger (hæmmer primær insulin men også GLP-1 sekretionen)
Octreotide (hurtigtvirkende) – det kan startes med 25 µg x 3 s.c. forud for de tre hovedmåltider, og øges til 50 µg x 3 hvis ingen bivirkninger, som patienter tager selv efter instruktion af sygeplejerske. Ved god effekt kan overgås til med langtidsvirkende analoger (man kan dog også starte med langtidsvirkende analoger).
Sandostatin LAR, der gives i.m hver 4 uge ved sygeplejerske. Her startes ud med 10 mg /4 uge og kan øges til 20 -40mg/4 uge, hvis ikke effekt ved lavere dosis. Hvis for mange bivirkninger eller manglende virkning kan forsøges med
Signifor (pasitreotid) (mere specifikt insulinhæmmende virkning)– der gives 10 mg hver 4 uge i.m., kan øges til 20 (30) mg hver 4 uge.
Alm. bivirkninger: diarré, kvalme, mavesmerter, træthed, galdesten, (hyperglykæmi/diabetes – især efter pasitreotide).
Blodprøver- før og i begyndelse af behandlingen: HbA1c, levertal, EKG (risiko for lav puls), overvej UL ved mistanke om galdesten. Ved udvikling af diabetes bør behandlingen stoppes.
Udlevering: Patienterne betaler ikke selv for somatostatin-analogerne, men får det udleveret fra amb/afdelingen. Det er generelt dyr behandling især ved anvendelse af Pasitreotide).
Behandlingstiden er uafklaret, men det foreslås at prøve at komme ud af behandlinger efter ca. 2 år. Ved recidiv at hypoglykæmierne må behandlingen genoptages.
Alternativt: Der er ganske mange andre medikamina der har været forsøgt (og forsøges) i behandlingen af PBH med mere eller mindre succes ( Verapramil, Diazoxide,GLP1-analoger, SGLT2-hæmmere mf.) og nye er under udvikling ( glucagon (langttidsvirkende), GLP1-receptor-antagonister).
- CGM med alarm
Nogle patienter tåler ikke den medicinske behandling eller ønsker den ikke, og ønsker ej heller tilbagelægning, men har stadig svære hypoglykæmiske symptomer – disse patienter kan tilbydes CGM med alarm, således at de kan nå at reagere i tide på et faldende BS samt lære deres individuelle reaktion på f.eks. kosten. Dvs at CGM i denne situation er et behandlingsredskab. Behandlingstiden vil i første omgang være ca. et år. Herefter revurdering af behovet. Rent praktisk står den lokale region for udleveringen. Om dette behandlingsprincip initieres lokalt eller via henvisning til højtspecialiseret afdeling afgøres at de lokale centres ekspertise.
- Kirurgisk
a. Sonde– Hvis den medicinske behandling ikke har virket tilfredsstillende eller har for mange bivirkninger, kan sonde forsøges. Sonden anlægges som en perkutan ernæringssonde i den udshuntede ventrikel via kirurgerne, hvor man via gastroskopien også sikre sig normale antomiske forhold sv.t. det bariatrisk indgreb . Patienten ernæres i de første dage til uger (kan være afhængig af lokale og individuelle forhold) udelukkende via denne sonde (væske uden energi kan tages p.o.). Hvis /når hypoglykæmierne forsvinder, kan der forsigtigt påbegyndes p.o ernæring som anført under den diætetiske behandling ved hypoglykæmi (kulhydratfattigt, lavt glykæmisk index fødevarer etc) samtidigt med fortsat sondeernæring. Dette princip kan anvendes forud for evt tilbagelægning af bypassen, men kan også stå alene i længere tid, hvis det ønskes. Denne behandling foregår i tæt samarbejde med diætisterne.
b. Tilbagelægning af bypassen: Dette indgreb besluttes ved MDT og udføres aktuelt på kir. afd. Aalborg Universitetshospital og Hvidovre hospital. Sædvanligvis forudgåes denne operation af nogle ugers ernæringssonde behandling (se ovenfor), hvor hypoglykæmierne gerne skulle være forsvundet.
Bivirkninger efter tilbagelægning: problemer med ventrikel stenose/retention der ofte kræver kirurgisk intervention (dilatation etc). Desuden vægtstigning. Disse pt følges i de bariatrisk centre indtil tilstanden er stabiliseret.
Højtspecialiseret funktion i relation til behandlingen af PBH.
Aarhus Universitetshospital og Hvidovre Hospital har denne funktion. Hvornår en given patient med PBH skal henvises til højtspecialiseret funktion afhænger af lokale forhold og ekspertise; men når diætetisk behandling med tillæg af Acarbose ikke har ført til tilfredstillende resultat og somatostation eller anden mere eksperimetal behandling overvejes , forslås at patienten henvisning. Når tilstanden er stabilseret evt under somatostation eller CGM behandling tilbagehenvises patienten. Evt sonde og evt indstilling til kirurgisk tilbagelægning sker også via de to højtspecialiserede afdelinger.
Algoritme for udredning og behandling

Referencer
- Salehi M, Vella A, McLaughlin T, Patti ME. Hypoglycemia After Gastric Bypass Surgery: Current Concepts and Controversies. The Journal of clinical endocrinology and metabolism. 2018;103(8):2815-26.
- Sheehan A, Patti ME. Hypoglycemia After Upper Gastrointestinal Surgery: Clinical Approach to Assessment, Diagnosis, and Treatment. Diabet Metab Synd Ob. 2020;13:4469-82.
- Scarpellini E, Arts J, Karamanolis G, Laurenius A, Siquini W, Suzuki H, et al. International consensus on the diagnosis and management of dumping syndrome. Nature reviews Endocrinology. 2020;16(8):448-66.
- Eisenberg D, Azagury DE, Ghiassi S, Grover BT, Kim JJ. ASMBS Position Statement on Postprandial Hyperinsulinemic Hypoglycemia after Bariatric Surgery. Surg Obes Relat Dis. 2017;13(3):371-8.
- Øhrstrøm CC, Worm D, Højager A et al. Postprandial hypoglycemia after Rous-en-Y gastric bypass abd the effects of acarbose, sitagliptin, verapramil, liraglutide and pasireotide. Diabetes Obes Metab 2019;21:2142-2151.
- Suhl E, Anderson-Haynes S-E, Milla C et al. Medical nutrition therapy for post-bariatric hypoglycemia: Practical insighhts. Surg. Obes Relat Dis 2017; 13(5): 888-896.
- American Diabetes Association. Standards of Medical Care in Diabetes. Diabetes Care 2020: 43 (Suppl. 1): S1-S212.
Arbejdsgruppe:
Tovholder: Bjørn Richelsen, professor, overlæge, Steno Diabetes Center Aarhus, Aarhus Universitetshospital
og
Carsten Dirksen, Torben Østergaard, Charlotte Røn Stolberg, Lene Hymøller Mundbjerg, Merethe Hansen.

