Hvad omfatter denne NBV
Opsummering af hyppigheden af endokrinopatier ved onkologisk behandling med immun checkpoint-inhibitorer:
- CTLA4 (cytotoxisk T-lymfocyt antigen 4) receptor inhibitorer (Ipilimumab (Yervoy®), Tremillimumab®),
- Anti-PD1 (programmed cell death protein 1) receptor antistoffer (Nivolumab (Opdivo®), Pembrolizumab (Keytruda®) og
- Anti -PD-L1 (PD-1 ligand) receptor antistoffer (Avelumab (Bavencio®), Durvalumab (Imfinzi®), Atezolizumab (Tecentriq®)).
Diagnostik og opfølgning af endokrinopatier opstået i relation til immun-onkologisk behandling med checkpoint-inhibitorer vil blive beskrevet i selvstændige afsnit med fokus på Hypofysitis, Thyroidea-påvirkning, Primær binyrebarkinsufficiens og Diabetes.
Hvad omfatter denne NBV ikke
Omfatter kun summarisk behandling af insufficiens og i øvrigt henvises til NBV for hypofyseinsufficiens,NBV for Thyroidit og NBV for binyrebarkinsufficiens.
Med hensyn til biokemisk monitorering under immun checkpoint-inhibitor behandling henvises til onkologisk vejledning på https://free.mymedcards.dk/myguides?q=immuntox.
Diagnosekoder
- DE230 Nedsat hormonsekretion fra hypofysen
- DE230b Isoleret nedsat sekretion af hypofysehormon UNS
- DE032 Hypothyroidisme forårsaget af lægemiddel eller andet fremmed agens
- DE064 Thyroiditis forårsaget af lægemiddel
- DE271 Primær binyrebarkinsufficiens
- DE273 Binyrebarkinsufficiens forårsaget af lægemiddel
- DE271B Autoimmun adrenalitis
- DK861F Autoimmun pankreatitis
- DE236 Anden sygdom i hypofysen
Visitation
Initial biokemisk diagnostik kan foregå på afdeling med hovedfunktionsniveau. Yderligere diagnostik og behandling af hypofysitis og binyrebarkinsufficiens er en medicinsk endokrinologisk regionsfunktion.
Definition
Endokrinopatier (hypofysitis, thyroiditis, primært myxødem, Graves’ hyperthyroidisme, sjældnere primær binyrebarkinsufficiens, type 1 diabetes mellitus, primær hypoparathyroidisme, primær hypogonadisme og autoimmun polyendokrint syndrom (APS)) som følge af immun-onkologisk behandling med checkpoint-inhibitorer. Endokrine bivirkninger til behandling med immunterapi er oftest milde-moderate (CTCAE grad 1-2), sjældnere mere alvorlige-livstruende (CTCAE grad 3-4). CTCAE = common terminology criteria for adverse events.
Forekomst
Næsten alle endokrinopatier er set, men hyppigst forekommer thyroideapåvirkning (2-15%)[1-4] og hypofysitis (1-8%)[1, 4, 5], sjældnere primær binyrebarkinsufficiens (<2%)[3, 6], mens type 1 diabetes[7-9], primær hypoparathyroidisme[10, 11], APS[12, 13] og central diabetes insipidus[14, 15] er kasuistisk beskrevet (Tabel 1).
Checkpoint blokade med PD1 eller PD-L1 antistoffer er især associeret med thyroideadysfunktion, mens behandling med CTLA4 antistoffer især er associeret med hypofysitis. Ved kombinationsbehandling med CTLA4 antistoffer og PD1 antistoffer /PD-L1 antistoffer ses en øget forekomst af alle former for endokrinopatier sammenlignet med monoterapi (Tabel 1).
Debut af endokrinopatier:
Debut er set så tidligt som 1 uge efter start af behandling (type 1 diabetes) og så sent som 416 uger efter start (Mb. Graves) med en median omkring 11 uger og de fleste indenfor 20 uger. Data på endokrinopatier efter behandlingsophør (delayed immune-related events) er vanskelig pga. protokoldesign (adverse events ofte ikke registreret hvis opstået>30 dage efter behandlings ophør) men binyrebarkinsufficiens er set så sent som 15 måneder efter behandlingsophør med en median på 6 måneder[16].
Tabel 1. Endokrinopatier, forekomst og klassisk debuttidspunkt ved anvendelse af forskellige typer af checkpoint-inhibitor behandlinger.
| Endokrinopati | Checkpoint-inhibitor | Forekomst | Kilde | Tid til debut (median [range]) | Kilde |
| Hypofysitis | Ipilimumab | 4-6% | [1-3, 5, 17] | 11 uger [4-16] | [18] |
| Nivolumab/ Pembrolizumab | 0,5-1% | [1-3, 5] | |||
| Ipilimumab+ Nivolumab/ Pembrolizumab | 4-14% | [1, 3-5, 19] | |||
| Thyroidea påvirkning* | Ipilimumab | 2-4% | [1-4] | Ukendt [1-19] | 13 |
| Nivolumab/ Pembrolizumab | 8% | [1-4] | Ukendt [4-44] | 13 | |
| Durvalumab/ Avelumab/ Atezolizumab | 5-8% | [3] | |||
| Ipilimumab+ Nivolumab/ Pembrolizumab | 15% | [1-4] | |||
| Primær binyrebarkinsufficiens | anti-CTLA4/anti-PD/ anti-PDL1 Ab monoterapi | <2% | [3] | ||
| Anti-CTLA4 + anti-PD/anti-PDL1 Ab | <4% | [3] | |||
| Type 1 diabetes | Anti-CTLA4 and/or anti-PD/anti-PDL1 | <2% | [3, 8, 9] |
*Overvejende stum thyroiditis.
Onkologisk screening for endokrinopatier
Onkologer screener for endokrinopatier med blodprøver (TSH og kortisol) før start og inden hver behandling samt ved klinisk mistanke. Behandling med checkpoint-inhibitorer gives som infusion med 2-6 ugers mellemrum afhængig af præparat og protokol. Se i øvrigt https://free.mymedcards.dk/myguides?q=immuntox.
Ætiologi
Målrettet hæmning af CTLA-4 receptoren på overfladen af aktiverede T-celler frigør immunsystemet fra den normale skelnen mellem ”self” og ”non-self”. Receptoren PD1 på overfladen af aktiverede T-celler kan blokeres af PD1 antistoffer, hvorved T-cellernes antitumor aktivitet fremmes. Samme effekt kan opnås med midler rettet mod PD-1 liganden[20].
Mulige årsager til hypofysitis sekundært til Ipilimumab: 1) Gentagne injektioner med Ipilimumab resulterer i komplement-aflejring på hypofysens hormon-producerende celler; 2) Udvikling af hypofyseantistoffer mod ACTH, TSH og gonadotropin secernerende celler[21]. Det vides ikke om mekanismen er ens for PD-1 antistoffer, PD-L1 inhibitorer og CTLA-4 inhibitorer.
Indikation for højdosis glukokortikoid
Ved immunterapi relaterede endokrinopatier vil man (i modsætning til ved ikke-endokrine bivirkninger) normalt ikke anvende højdosis steroidbehandling, idet data tyder på, at steroider ikke har nogen effekt på den initiale sværhedsgrad endsige recovery[22, 23].
Hypofysitis
Hypofyseinsufficiens opstået som følge af immun checkpoint-inhibitor behandling.
Lokalsymptomer i form af hovedpine og sjældnere synsforstyrrelser (dobbeltsyn og synsfeltsudfald) – hyppigere ved anti-CTLA4 end anti-PD-1/PDL1 – samt almene symptomer betinget af hypofyseinsufficiensen (træthed, kvalme, nedsat appetit, svimmelhed, nedsat libido og rejsningsbesvær). Sjældnere mere specifikke symptomer på akseudfald med akut binyrebarkinsufficiens og meget sjældent diabetes insipidus med polydipsi og polyuri. Undertiden ses kun almene symptomer, der kan være svære at skelne fra de symptomer, som ses hos patienter i onkologisk behandling. Således opdages hypofysitis ofte mere eller mindre tilfældigt ved rutinemæssig biokemisk screening af onkologiske patienter i checkpoint-inhibitor behandling.
Vigtigst er at udelukke binyrebarkinsufficiens og der skelnes mellem situationer med:
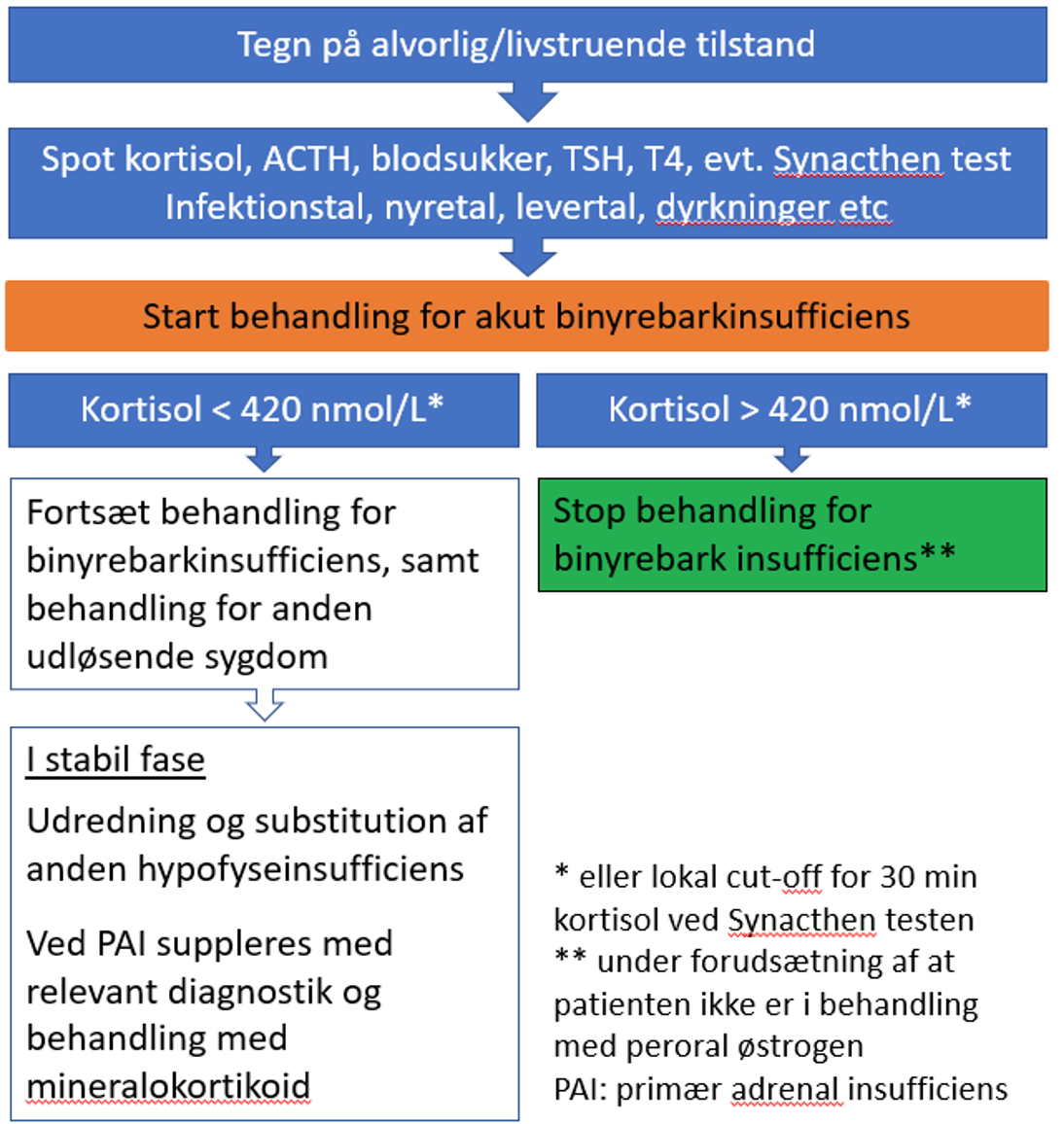
- Tegn på alvorlig/livstruende tilstand: Se figur 1.
- Kun milde til moderate symptomer: Se figur 2
Udredning i øvrigt:
- Hypofyseprøver: ACTH, kortisol, TSH, T3, T4, prolaktin, FSH, LH, østradiol, testosteron, evt. IGF-1.
- Synacthen®-test:
- Kortisol under 30 minutters cut-off værdi bekræfter binyrebarkinsufficiens.
- Falsk normal synacthen-test kan ses ved kort varighed af hypofysitis og i disse tilfælde må en hurtig måling og analyse af spot-kortisol prioriteres (se flow chart).
- Ved tvivl og såfremt patienten er klinisk dårlig, igangsættes solu-cortef® behandling og diagnosen revurderes ved gentagen synacthen-test senere. Se i øvrigt NBV for Binyrebarkinsufficiens.
- Væsketal og P-glukose.
- MR af hypofysen:
- Anvendes differential diagnostisk ved svær/invaliderende hovedpine, øjenmuskelpareser, diabetes insipidus eller synsforstyrrelser med henblik på at udelukke metastaser / apoplexi.
- MR forandringer forenelige med hypofysitis er oftest forbigående diffus forstørrelse af hypofysen[24, 25] uden chiasma påvirkning (max 3 måneder).
Det biokemiske billede sløres ofte af:
- igangværende binyrebarkhormon behandling (ex. som led i ’kvalmepakke’)
- kronisk sygdom (med varierende grader af ”euthyroid sick syndrome/non-thyroidal sygdom”, hypothalamisk betinget hypogonadisme og albumin/TBG/SHBG -afvigelser)
- andre samtidige autoimmune sygdomme især thyroiditis, hvilket gør diagnosen hypofysitis vanskelig at stille i fald hypofyse-binyre-aksen ikke er ramt.
Hyppigheden af hormonudfald ved hypofysitis[17, 18, 26-28]:
- Sekundær binyrebarkinsufficiens 57%-100%
- Hypogonadotrop hypogonadisme 82 %
- Central hypothyroidisme 78%
- Hyperprolaktinæmi 10%
- Hypoprolaktinæmi 50%
- Diabetes insipidus < 5%
Ved anti-PD1/PD-L1 induceret hypofysitis ses hyppigst isoleret sekundær binyrebarkinsufficiens med normal MR[29] i modsætning til ved hypofysitis induceret af behandling hvor CTLA4-inhibitor indgår.
Binyrebark-insufficiens substitueres akut og de øvrige hypofyseakser vurderes i rolig fase med henblik på substitutionsbehandling [jvf. flowchart 2]. Der behandles efter NBV for Binyrebarkinsufficiens og NBV for Hypofyseinsufficiens.
NB: Upåvirkede patienter med biokemiske tegn på binyrebarkinsufficiens kan opstarte behandling med per oral hydrocortison® jvf. flowchart 1. Der udleveres information om forholdsregler ved binyrebarkinsufficiens samt krise-kort – se NBV for Binyrebarkinsufficiens.
Beslutning om højdosis glukokortikoid behandling som led i varetagelse af CTCAE varetages af onkologer i henhold til https://free.mymedcards.dk/myguides?q=immuntox. Højdosis glukokortikoidbehandling synes IKKE at påvirke remissionen af hverken hypofyseinsufficiens, symptomer eller hypofyseforstørrelsen, men synes derimod at være associeret med reduceret overlevelse23. Fra et endokrinologisk synspunkt er der dermed sjældent grundlag for højdosis glukokortikoid behandling. https://immuntox.dk/app/www/ . I tilfælde af hypofyseødem eller svær hovedpine giver onkologerne oftest oral Prednisolon 50-100 mg dagligt til fravær af hovedpine og der aftrappes over 4 uger, men se ovennævnte link for opdateringer. Hypofysitis uden ledsagende hypofyseødem/hovedpine behandles derimod oftest uden højdosis steroid og under fortsættelse af immunterapien.
Figur 1. Håndtering af patienter i behandling med check-point inhibitorer med svære/livstruende symptomer forenelige med binyrebarkinsufficiens. Stillingtagen til højdosis glukokortikoid behandling samt pausering af check-point hæmmer efter samråd med onkolog.
Figur 2. Håndtering af patienter i behandling med check-point hæmmere med milde/moderate symptomer forenelige med binyrebarkinsufficiens.
ACTH-mangel synes oftest permanent[17, 22]. FSH, LH og testosteron/østrogen-funktionen genvindes ofte (57 %), mens det for TSH er varierende (37-50 %)[17, 18, 22, 28].
Forslag til opfølgning: Behandlingskontrol efter 7 dage. Kontrol af hypofyseprøver samt sikre patientens forståelse for behandlingen inkl. håndtering af stressdoser (se NBV for Binyrebarkinsufficiens) efter ca. 6 uger, 4 måneder og 1 år afhængig af initiale biokemi. Behov for Synacthen-test vurderes ud fra biokemi og symptomer.
Thyroideadysfunktion
Thyroidea dysfunktion kan optræde som stum thyroiditis, primær hypothyroidisme eller sjældent Graves’ hyperthyroidisme. Symptomerne i den hyperthyroide fase af den stumme thyroidit er sjældent udtalte.
Der henvises til NBV for Thyroidit.
- TSH, T4, (T3)
- TPOAb, TRAb
- Thyroideaskintigrafi og/eller ultralyd af thyroidea mhp differential diagnostik overfor Graves’ hyperthyroidisme
Differential diagnostik: Overvej Iod kontrast eller cordarone -induceret thyroiditis. Ved lav T4 og TSH <10 må overvejes hypofysært myxødem/hypofysitis, hvilket er vigtigt, da thyroideasubstitution kan demaskere evt. binyrebarkinsufficiens som led i hypofysit.
Se NBV for Thyroidit og hvis relevant evt. NBV for Thyrotoxikose eller NBV for Hypothyroidisme.
Symptomatisk behandling med non-selektiv beta-blokker ved takykardi/tremor (OBS kontraindikationer herunder hjertesvigt). Effekten af højdosis glukokortikoid behandling er tvivlsom, hvad angår remission af thyroiditis og anbefales ikke fra endokrinologisk side. Levothyroksin behandling opstartes ved hypothyroide symptomer eller tilsyneladende varigt myxødem. Startdosis f.eks. Tabl. Eltroxin 50-100 mikrogram x 1 dagligt.
Ved thyroidit er risikoen for permanent hypothyreose stor under behandling med PD1 antistoffer2,4,18. Dette er i kontrast til de ofte forbigående thyroiditter udløst af anden onkologisk behandling (f.eks. interferon-α, proteinkinase hæmmere).
Ved mistænkt primær hypothyroidisme kan en overset forudgående hyperthyroid fase som led i en stum thyroidit ikke udelukkes, og der kan eventuelt gøres et seponeringsforsøg af behandlingen med levothyroksin.
Thyroideatal initialt f.eks. hver 4. uge. Evt. før ved væsentlige thyreotoxiske symptomer. Forsøgsvis udtrapning af levothyroxin behandling kan overvejes på sigt.
Primær binyrebarkinsufficiens
Primær binyrebarkinsufficiens er en meget sjælden bivirkning. Den kendetegnes ved høj ACTH (> x2 forhøjet), insufficient kortisol-respons på synacthen-test og samtidig mineralokortikoid insufficiens. Den akutte behandling er som for hypofysært udløst binyrebarkinsufficiens, men risiko for kredsløbskollaps er større grundet mineralokortikoid insufficiens. Differentialdiagnostisk skal overvejes bilaterale adrenale metastaser eller adrenal hæmoragi. Der henvises til NBV for Binyrebarkinsufficiens samt afsnit om hypofysitis ovenfor.
Type 1 Diabetes
Type 1 diabetes er en sjælden, men alvorlig bivirkning til behandling med immun check-point inhibitorer, er sjældent reversibel4og er oftest beskrevet hos patienter behandlet med PD-1 inhibitorer[30, 31]. Debuten er ofte hyperakut med ketoacidose. Kun halvdelen har positive GAD65 antistoffer og C-peptid synes mere anvendelig til at understøtte diagnosen. HLA-DR4 vævstypen forekommer hyppigere hos disse patienter. Anvendelsen af højdosis prednisolon behandling synes ikke tilstrækkeligt belyst, hvad angår remission af type 1 diabetes og frarådes fra endokrinologisk side.
Diabetes induceret af højdosis prednisolon er hyppigere hos cancerpatienter og mhp. differential diagnostik foreslås måling af C-peptid ved patienter med nydiagnosticeret diabetes.
Referencer
1. Barroso-Sousa R, Barry WT, Garrido-Castro AC, Hodi FS, Min L, Krop IE, et al. Incidence of Endocrine Dysfunction Following the Use of Different Immune Checkpoint Inhibitor Regimens: A Systematic Review and Meta-analysis. JAMA oncology. 2018;4(2):173-82. Epub 2017/10/04. doi: 10.1001/jamaoncol.2017.3064. PubMed PMID: 28973656; PubMed Central PMCID: PMCPMC5838579 Bristol-Myers Squibb and serving as a consultant to MERCK, Novartis, and EMD Serono. Dr Krop reports receiving research support from Genentech. Dr Tolaney reports receiving research support from MERCK, Bristol-Myers Squibb, and Genetech. No other disclosures are reported.
2. Morganstein DL, Lai Z, Spain L, Diem S, Levine D, Mace C, et al. Thyroid abnormalities following the use of cytotoxic T-lymphocyte antigen-4 and programmed death receptor protein-1 inhibitors in the treatment of melanoma. Clinical endocrinology. 2017;86(4):614-20. Epub 2016/12/29. doi: 10.1111/cen.13297. PubMed PMID: 28028828.
3. de Filette J, Andreescu CE, Cools F, Bravenboer B, Velkeniers B. A Systematic Review and Meta-Analysis of Endocrine-Related Adverse Events Associated with Immune Checkpoint Inhibitors. Hormone and metabolic research = Hormon- und Stoffwechselforschung = Hormones et metabolisme. 2019;51(3):145-56. Epub 2019/03/13. doi: 10.1055/a-0843-3366. PubMed PMID: 30861560.
4. Spain L, Diem S, Larkin J. Management of toxicities of immune checkpoint inhibitors. Cancer treatment reviews. 2016;44:51-60. Epub 2016/02/15. doi: 10.1016/j.ctrv.2016.02.001. PubMed PMID: 26874776.
5. Larkin J, Chiarion-Sileni V, Gonzalez R, Grob JJ, Cowey CL, Lao CD, et al. Combined Nivolumab and Ipilimumab or Monotherapy in Untreated Melanoma. The New England journal of medicine. 2015;373(1):23-34. Epub 2015/06/02. doi: 10.1056/NEJMoa1504030. PubMed PMID: 26027431; PubMed Central PMCID: PMCPMC5698905.
6. Shi Y, Shen M, Zheng X, Yang T. Immune Checkpoint Inhibitor-Induced Adrenalitis and Primary Adrenal Insufficiency: Systematic Review and Optimal Management. Endocrine practice : official journal of the American College of Endocrinology and the American Association of Clinical Endocrinologists. 2021;27(2):165-9. Epub 2021/02/09. doi: 10.1016/j.eprac.2020.09.016. PubMed PMID: 33554872.
7. Sakurai K, Niitsuma S, Sato R, Takahashi K, Arihara Z. Painless Thyroiditis and Fulminant Type 1 Diabetes Mellitus in a Patient Treated with an Immune Checkpoint Inhibitor, Nivolumab. The Tohoku journal of experimental medicine. 2018;244(1):33-40. Epub 2018/01/19. doi: 10.1620/tjem.244.33. PubMed PMID: 29343652.
8. Aleksova J, Lau PK, Soldatos G, McArthur G. Glucocorticoids did not reverse type 1 diabetes mellitus secondary to pembrolizumab in a patient with metastatic melanoma. BMJ case reports. 2016;2016. Epub 2016/11/25. doi: 10.1136/bcr-2016-217454. PubMed PMID: 27881588; PubMed Central PMCID: PMCPMC5174822.
9. Hughes J, Vudattu N, Sznol M, Gettinger S, Kluger H, Lupsa B, et al. Precipitation of autoimmune diabetes with anti-PD-1 immunotherapy. Diabetes care. 2015;38(4):e55-7. Epub 2015/03/26. doi: 10.2337/dc14-2349. PubMed PMID: 25805871; PubMed Central PMCID: PMCPMC4370325.
10. Win MA, Thein KZ, Qdaisat A, Yeung SJ. Acute symptomatic hypocalcemia from immune checkpoint therapy-induced hypoparathyroidism. The American journal of emergency medicine. 2017;35(7):1039.e5-.e7. Epub 2017/04/02. doi: 10.1016/j.ajem.2017.02.048. PubMed PMID: 28363614.
11. Piranavan P, Li Y, Brown E, Kemp EH, Trivedi N. Immune Checkpoint Inhibitor-Induced Hypoparathyroidism Associated With Calcium-Sensing Receptor-Activating Autoantibodies. The Journal of clinical endocrinology and metabolism. 2019;104(2):550-6. Epub 2018/09/27. doi: 10.1210/jc.2018-01151. PubMed PMID: 30252069.
12. Lanzolla G, Coppelli A, Cosottini M, Del Prato S, Marcocci C, Lupi I. Immune Checkpoint Blockade Anti-PD-L1 as a Trigger for Autoimmune Polyendocrine Syndrome. Journal of the Endocrine Society. 2019;3(2):496-503. Epub 2019/02/13. doi: 10.1210/js.2018-00366. PubMed PMID: 30746508; PubMed Central PMCID: PMCPMC6364624.
13. Gunjur A, Klein O, Kee D, Cebon J. Anti-programmed cell death protein 1 (anti-PD1) immunotherapy induced autoimmune polyendocrine syndrome type II (APS-2): a case report and review of the literature. Journal for immunotherapy of cancer. 2019;7(1):241. Epub 2019/09/07. doi: 10.1186/s40425-019-0713-y. PubMed PMID: 31488221; PubMed Central PMCID: PMCPMC6729071.
14. Yu M, Liu L, Shi P, Zhou H, Qian S, Chen K. Anti-PD-1 treatment-induced immediate central diabetes insipidus: a case report. Immunotherapy. 2021;13(15):1255-60. Epub 2021/08/24. doi: 10.2217/imt-2020-0334. PubMed PMID: 34424037.
15. Deligiorgi MV, Siasos G, Vergadis C, Trafalis DT. Central diabetes insipidus related to anti-programmed cell-death 1 protein active immunotherapy. International immunopharmacology. 2020;83:106427. Epub 2020/04/04. doi: 10.1016/j.intimp.2020.106427. PubMed PMID: 32244049.
16. Couey MA, Bell RB, Patel AA, Romba MC, Crittenden MR, Curti BD, et al. Delayed immune-related events (DIRE) after discontinuation of immunotherapy: diagnostic hazard of autoimmunity at a distance. Journal for immunotherapy of cancer. 2019;7(1):165. Epub 2019/07/05. doi: 10.1186/s40425-019-0645-6. PubMed PMID: 31269983; PubMed Central PMCID: PMCPMC6609357.
17. Albarel F, Gaudy C, Castinetti F, Carré T, Morange I, Conte-Devolx B, et al. Long-term follow-up of ipilimumab-induced hypophysitis, a common adverse event of the anti-CTLA-4 antibody in melanoma. European journal of endocrinology. 2015;172(2):195-204. Epub 2014/11/25. doi: 10.1530/eje-14-0845. PubMed PMID: 25416723.
18. Dillard T, Yedinak CG, Alumkal J, Fleseriu M. Anti-CTLA-4 antibody therapy associated autoimmune hypophysitis: serious immune related adverse events across a spectrum of cancer subtypes. Pituitary. 2010;13(1):29-38. Epub 2009/07/30. doi: 10.1007/s11102-009-0193-z. PubMed PMID: 19639414.
19. Jessel S, Weiss SA, Austin M, Mahajan A, Etts K, Zhang L, et al. Immune Checkpoint Inhibitor-Induced Hypophysitis and Patterns of Loss of Pituitary Function. Frontiers in oncology. 2022;12:836859. Epub 2022/03/31. doi: 10.3389/fonc.2022.836859. PubMed PMID: 35350573; PubMed Central PMCID: PMCPMC8958012.
20. Topalian SL, Hodi FS, Brahmer JR, Gettinger SN, Smith DC, McDermott DF, et al. Safety, activity, and immune correlates of anti-PD-1 antibody in cancer. The New England journal of medicine. 2012;366(26):2443-54. Epub 2012/06/05. doi: 10.1056/NEJMoa1200690. PubMed PMID: 22658127; PubMed Central PMCID: PMCPMC3544539.
21. Iwama S, De Remigis A, Callahan MK, Slovin SF, Wolchok JD, Caturegli P. Pituitary expression of CTLA-4 mediates hypophysitis secondary to administration of CTLA-4 blocking antibody. Science translational medicine. 2014;6(230):230ra45. Epub 2014/04/04. doi: 10.1126/scitranslmed.3008002. PubMed PMID: 24695685.
22. Faje AT, Lawrence D, Flaherty K, Freedman C, Fadden R, Rubin K, et al. High-dose glucocorticoids for the treatment of ipilimumab-induced hypophysitis is associated with reduced survival in patients with melanoma. Cancer. 2018;124(18):3706-14. Epub 2018/07/06. doi: 10.1002/cncr.31629. PubMed PMID: 29975414.
23. Ma C, Hodi FS, Giobbie-Hurder A, Wang X, Zhou J, Zhang A, et al. The Impact of High-Dose Glucocorticoids on the Outcome of Immune-Checkpoint Inhibitor-Related Thyroid Disorders. Cancer immunology research. 2019;7(7):1214-20. Epub 2019/05/16. doi: 10.1158/2326-6066.cir-18-0613. PubMed PMID: 31088848; PubMed Central PMCID: PMCPMC6606328.
24. Bronstein Y, Ng CS, Hwu P, Hwu WJ. Radiologic manifestations of immune-related adverse events in patients with metastatic melanoma undergoing anti-CTLA-4 antibody therapy. AJR American journal of roentgenology. 2011;197(6):W992-w1000. Epub 2011/11/24. doi: 10.2214/ajr.10.6198. PubMed PMID: 22109345.
25. Faje AT, Sullivan RJ. Reply to emergency management of immune-related hypophysitis: Collaboration between specialists is essential to achieve optimal outcomes. Cancer. 2018;124(24):4732. Epub 2018/10/24. doi: 10.1002/cncr.31786. PubMed PMID: 30351493.
26. Alhusseini M, Samantray J. Hypothyroidism in Cancer Patients on Immune Checkpoint Inhibitors with anti-PD1 Agents: Insights on Underlying Mechanisms. Experimental and clinical endocrinology & diabetes : official journal, German Society of Endocrinology [and] German Diabetes Association. 2017;125(4):267-9. Epub 2017/01/11. doi: 10.1055/s-0042-119528. PubMed PMID: 28073132.
27. Corsello SM, Barnabei A, Marchetti P, De Vecchis L, Salvatori R, Torino F. Endocrine side effects induced by immune checkpoint inhibitors. The Journal of clinical endocrinology and metabolism. 2013;98(4):1361-75. Epub 2013/03/09. doi: 10.1210/jc.2012-4075. PubMed PMID: 23471977.
28. Juszczak A, Gupta A, Karavitaki N, Middleton MR, Grossman AB. Ipilimumab: a novel immunomodulating therapy causing autoimmune hypophysitis: a case report and review. European journal of endocrinology. 2012;167(1):1-5. Epub 2012/04/13. doi: 10.1530/eje-12-0167. PubMed PMID: 22495490.
29. Faje A, Reynolds K, Zubiri L, Lawrence D, Cohen JV, Sullivan RJ, et al. Hypophysitis secondary to nivolumab and pembrolizumab is a clinical entity distinct from ipilimumab-associated hypophysitis. European journal of endocrinology. 2019;181(3):211-9. Epub 2019/06/09. doi: 10.1530/eje-19-0238. PubMed PMID: 31176301.
30. Kotwal A, Haddox C, Block M, Kudva YC. Immune checkpoint inhibitors: an emerging cause of insulin-dependent diabetes. BMJ open diabetes research & care. 2019;7(1):e000591. Epub 2019/03/23. doi: 10.1136/bmjdrc-2018-000591. PubMed PMID: 30899528; PubMed Central PMCID: PMCPMC6398813.
31. Lu J, Yang J, Liang Y, Meng H, Zhao J, Zhang X. Incidence of Immune Checkpoint Inhibitor-Associated Diabetes: A Meta-Analysis of Randomized Controlled Studies. Frontiers in pharmacology. 2019;10:1453. Epub 2020/01/11. doi: 10.3389/fphar.2019.01453. PubMed PMID: 31920646; PubMed Central PMCID: PMCPMC6915045.
Tovholder
Øvrig arbejdsgruppe:
Christian Trolle
Åse Krogh Rasmussen
Rúna Louise M. Nolsøe
Claus Larsen Feltoft
Hanne Mumm
Gry Høst Dørflinger
Anne Benedicte Juul
Stinus Gadegaard Hansen
Jakob Dal
Oprettet: 2019
Seneste revision: 2022
Næste revision: 2025
Interessekonflikter:
Ingen